苯
| 苯 | |||
|---|---|---|---|

| |||
| |||
| |||
| IUPAC名 Benzene 苯 | |||
| 識別 | |||
| CAS號 | 71-43-2 | ||
| PubChem | 241 | ||
| ChemSpider | 236 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | UHOVQNZJYSORNB-UHFFFAOYAH | ||
| ChEBI | 16716 | ||
| RTECS | CY1400000 | ||
| 性質 | |||
| 化學式 | C6H6 | ||
| 莫耳質量 | 78.11 g·mol−1 | ||
| 外觀 | 無色透明易揮發液體 | ||
| 密度 | 0.8765 (20) g/cm3 [1] | ||
| 熔點 | 5.5 °C(279 K) | ||
| 沸點 | 78.3 °C(351 K) | ||
| 溶解性(水) | 1.8 g/L(15 ℃)[2][3][4] | ||
| 黏度 | 0.652 cP,20℃時 | ||
| 偶極矩 | 0 D | ||
| 熱力學 | |||
| S⦵298K | 173.26 J/mol·K | ||
| 熱容 | 135.69 J/mol·K(298.15 K) | ||
| 危險性 | |||
| 警示術語 | R:R45-R46-R11-R36/38-R48/23/24/25-R65 | ||
| 安全術語 | S:S53-S45 | ||
| 歐盟分類 | 可燃(F) Carc. Cat. 1 Muta. Cat. 2 有毒(T) | ||
| NFPA 704 | |||
| 閃點 | −10.11℃(閉杯) | ||
| 自燃溫度 | 562.22℃ | ||
| 相關物質 | |||
| 相關化學品 | 甲苯 環硼氮烷 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
苯是最簡單的芳烴,難溶於水,易溶於有機溶劑,本身也可作為有機溶劑。苯是石油化工基本原料,其產量和生產的技術水準是國家石油化工發展水準的標誌。苯具有的環系叫苯環,是最簡單的芳環。苯分子去掉一個氫以後的結構叫苯基,用Ph表示;因此苯也可表示為PhH。
發現

苯最早是在18世紀初研究將煤氣作為照明用氣時合成出來的。一般認為苯是在1825年由麥可·法拉第發現的。他從魚油等類似物質的熱裂解產品中分離出了較高純度的苯,稱之為「氫的重碳化物」(Bicarburet of hydrogen)。[6]並且測定了苯的一些物理性質和它的化學組成,闡述了苯分子的碳氫比。[7]
1833年,米修里希·伊爾哈得確定了苯分子中6個碳和6個氫原子的經驗式(C6H6)。[8]弗里德里希·凱庫勒於1865年提出了苯環單、雙鍵交替排列、無限共軛的結構,即現在所謂「凱庫勒式」。據稱他是因為夢到一條蛇咬住了自己的尾巴才受到啟發想出「凱庫勒式」的。[9]他又對這一結構作出解釋說環中雙鍵位置不是固定的,可以迅速移動,所以造成6個碳等價。他通過對苯的一氯代物、二氯代物種類的研究,發現苯是環形結構,每個碳連接一個氫。也有說法指出,把苯的分子結構畫成六角形環狀結構最早是法國化學家奧古斯特·勞倫1854年在《化學方法》一書中提出的。但是出於某種原因,凱庫勒在論文沒有提及勞倫的成果。[9]
也有人提出了其他的設想:比如詹姆斯·杜瓦就歸納出不同結構;以其命名的杜瓦苯現已被證實是與苯不同的另外一種物質,可由苯經光照得到。

1845年德國化學家霍夫曼從煤焦油的輕餾分中發現了苯,他的學生查爾斯·曼斯菲爾德(Charles Mansfield)隨後進行了加工提純。後來他又發明了結晶法精製苯。他還進行工業應用的研究,開創了苯的加工利用途徑。大約從1865年起開始了苯的工業生產。最初是從煤焦油中回收。隨著它的用途的擴大,產量不斷上升,到1930年已經成為世界十大噸位產品之一。
結構
苯具有的苯環結構導致它有特殊的芳香性。苯環是最簡單的芳環,由六個碳原子構成一個六元環,每個碳原子接一個基團,苯的6個基團都是氫原子。

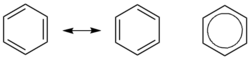
苯不是單、雙鍵交替排列的輪烯,原子間成鍵並不是不連續的單雙鍵交替,而是被離域π電子云覆蓋。參見芳香環。
苯分子是平面分子,12個原子處於同一平面上,6個碳和6個氫是均等的,C-H鍵長為1.08Å,C-C鍵長為1.40Å,此數值介於單雙鍵長之間。分子中所有鍵角均為120°,說明碳原子都採取sp2雜化。這樣每個碳原子還剩餘一個p軌道垂直於分子平面,每個軌道上有一個電子。於是6個軌道重疊形成離域大Π鍵(即π66),存在下圖所示的共振式,現在認為這是苯環非常穩定的原因,也直接導致了苯環的芳香性。
從分子軌道理論來看,可以認為苯的6個p軌道相互作用形成6個π分子軌道,其中ψ1、ψ2、ψ3是能量較低的成鍵軌道,ψ4、ψ5、ψ6是能量較高的反鍵軌道。ψ2、ψ3和ψ4、ψ5是兩對簡併軌道。基態時苯的電子云分布是三個成鍵軌道疊加的結果,故電子雲均勻分布於苯環上下及環原子上,形成閉合的電子雲。它是苯分子在磁場中產生環電流的根源。
物理性質
苯的沸點為80.1℃,熔點為5.5℃,在常溫下是一種無色、有芳香氣味的透明液體,易揮發。苯比水密度低,密度為0.88g/ml,但其分子質量比水重。苯難溶於水,1升水中最多溶解1.8g苯;但苯是一種良好的有機溶劑,溶解有機分子和一些非極性的無機分子的能力很強。
苯能與水生成恆沸物,沸點為69.25℃,含苯91.2%。因此,在有水生成的反應中常加苯蒸餾,以將水帶出。
在10~1500毫米Hg之間的飽和蒸氣壓可以根據安托萬方程計算:
其中:P單位為mmHg,t單位為℃,A = 6.91210,B = 1214.645,C = 221.205。
化學性質
苯參加的化學反應大致有3種:一種是其他基團和苯環上的氫原子之間發生的取代反應;一種是發生在C=C雙鍵上的加成反應;一種是苯環的斷裂。
取代反應
苯環上的氫原子在一定條件下可以被鹵素、硝基、磺酸基、烴基等取代,生成相應的衍生物。由於取代基的不同以及氫原子位置的不同、數量不同,可以生成不同數量和結構的同分異構體。
苯環的電子云密度較大,所以發生在苯環上的取代反應大都是親電取代反應。親電取代反應是芳環有代表性的反應。苯的取代物在進行親電取代時,第二個取代基的位置與原先取代基的種類有關。
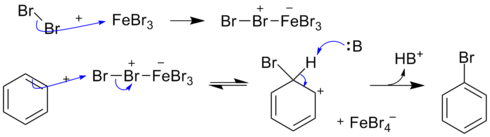
鹵代反應
苯的鹵代反應的通式可以寫成:
反應過程中,鹵素分子在苯和催化劑的共同作用下異裂,X+進攻苯環,X-與催化劑結合。以溴為例:反應需要加入鐵粉,鐵在溴作用下先生成三溴化鐵。
反應機理為:
硝化反應
硝化反應是一個強烈的放熱反應,很容易生成一取代物,但是進一步反應速度較慢。
磺化反應
磺化是可逆反應,苯磺酸在加熱下與稀硫酸或鹽酸反應,可失去磺基,生成苯。所以在合成時可以通過磺化反應保護芳核上的某一位置。
苯環上引入一個磺酸基後反應能力下降,不易進一步磺化,需要更高的溫度才能引入第二、第三個磺酸基。這說明硝基、磺酸基都是鈍化基團,即妨礙再次親電取代進行的基團。
傅-克反應
在AlCl3催化下,苯也可以和醇、烯烴和鹵代烴反應,苯環上的氫原子被烷基取代生成烷基苯。這種反應稱為烷基化反應,又稱為傅-克烷基化反應。[10]例如與乙烯烷基化生成乙苯:
在反應過程中,R基可能會發生重排:如1-氯丙烷與苯反應生成異丙苯,這是由於自由基總是趨向穩定的構型。
在強路易斯酸催化下,苯與醯氯或者羧酸酐反應,苯環上的氫原子被醯基取代生成醯基苯。反應條件類似烷基化反應。
加成反應
苯環雖然很穩定,但是在一定條件下也能夠發生雙鍵的加成反應。通常經過催化加氫,蘭尼鎳/鈀/鉑作催化劑,苯可以生成環己烷。
此外由苯生成六氯環己烷(六六六)的反應可以在紫外線照射的條件下,由苯和氯氣加成而得。
氧化反應
苯和其他的烴一樣,都能燃燒。當氧氣充足時,產物為二氧化碳和水。
苯在特定情況下也可被臭氧氧化,產物是乙二醛。這個反應可以看作是苯的離域電子定域後生成的環狀多烯烴發生的臭氧化反應。
但是在一般條件下,苯不能被強氧化劑所氧化。但是在氧化鉬、五氧化二釩等催化劑存在下,與空氣中的氧在500℃時反應,苯可以選擇性的氧化成順丁烯二酸酐。這是屈指可數的幾種能破壞苯的六元碳環系的反應之一。(馬來酸酐是五元雜環。)
這是一個強烈的放熱反應。
其他反應
苯在高溫下,用鐵、銅、鎳做催化劑,可以發生縮合反應生成聯苯。[11]和甲醛及次氯酸在氯化鋅存在下可生成氯甲基苯。和乙基鈉等烷基金屬化物反應可生成苯基金屬化物。在四氫呋喃中氯苯或溴苯和鎂反應可生成苯基格林尼亞試劑。
苯環的親電取代定位效應
第一類鄰、對位定位基
鄰、對位定位基亦被稱為o(ortho)、p(para)定位基,可使新的取代基主要進入鄰、對位(o+p>60%),除了鹵素以外都可使苯環活化,有利於親電取代反應的進行。[12]
第二類間位定位基
間位定位基亦被稱為m(meta)定位基,可使新的定位基主要進入間位(m>40%),並使苯環鈍化,不利於親電取代反應的進行。[12]
製備
苯可以由含碳量高的物質不完全燃燒獲得。自然界中,火山爆發和森林火災都能生成苯。苯也存在於香菸的煙中。
直至二戰,苯還是一種鋼鐵工業焦化過程中的副產物。這種方法只能從1噸煤中提取出1公斤苯。1950年代後,隨著工業上,尤其是日益發展的塑料工業對苯的需求增多,由石油生產苯的過程應運而生。現在全球大部分的苯來源於石油化工。工業上生產苯最重要的三種過程是催化重整、甲苯加氫脫烷基化和蒸汽裂化。
從煤焦油中提取
在煤煉焦過程中生成的輕焦油含有大量的苯。這是最初生產苯的方法。將生成的煤焦油和煤氣一起通過洗滌和吸收設備,用高沸點的煤焦油作為洗滌和吸收劑回收煤氣中的煤焦油,蒸餾後得到粗苯和其他高沸點餾分。粗苯經過精製可得到工業級苯。這種方法得到的苯純度比較低,而且環境污染嚴重,工藝比較落後。
從石油中提取
在原油中含有少量的苯,從石油產品中提取苯是最廣泛使用的製備方法。
催化重整
重整這裡指使脂肪烴成環、脫氫形成芳香烴的過程。這是從第二次世界大戰期間發展形成的工藝。
在500-525 ℃、8-50個大氣壓下,各種沸點在60-200 ℃之間的脂肪烴,經鉑-錸催化劑,通過脫氫、環化轉化為苯和其他芳香烴。從混合物中萃取出芳香烴產物後,再經蒸餾即分出苯。也可以將這些餾分用作汽油。
蒸汽裂解
蒸汽裂解是由乙烷、丙烷或丁烷等低分子烷烴以及石腦油、重柴油等石油組份生產烯烴的一種過程。其副產物之一裂解汽油富含苯,可以分餾出苯及其他各種成分。裂解汽油也可以與其他烴類混合作為汽油的添加劑。
裂解汽油中苯大約有40-60%,同時還含有二烯烴以及苯乙烯等其他不飽和組份,這些雜質在貯存過程中易進一步反應生成高分子膠質。所以要先經過加氫處理過程來除去裂解汽油中的這些雜質和硫化物,然後再進行適當的分離得到苯產品。
芳烴分離
從不同方法得到的含苯餾分,其組分非常複雜,用普通的分離方法很難見效,一般採用溶劑進行液-液萃取或者萃取蒸餾的方法進行芳烴分離,然後再採用一般的分離方法分離苯、甲苯、二甲苯。根據採用的溶劑和技術的不同又有多種分離方法。
- Udex法:由美國道化學公司和UOP公司在1950年聯合開發,最初用二乙二醇醚作溶劑,後來改進為三乙二醇醚和四乙二醇醚作溶劑,過程採用多段升液通道(multouocomer)萃取器。苯的收率為100%。
- Suifolane法:荷蘭殼牌公司開發,專利為UOP公司所有。溶劑採用環丁碸,使用轉盤萃取塔進行萃取,產品需經白土處理。苯的收率為99.9%。
- Arosolvan法:由聯邦德國的魯奇公司在1962年開發。溶劑為N-甲基吡咯烷酮(NMP),為了提高收率,有時還加入10-20%的乙二醇醚。採用特殊設計的Mechnes萃取器,苯的收率為99.9%。
- IFP法:由法國石油化學研究院在1967年開發。採用不含水的二甲亞碸作溶劑,並用丁烷進行反萃取,過程採用轉盤塔。苯的收率為99.9%。
- Formex法:為義大利SNAM公司和LRSR石油加工部在1971年開發。嗎啉或N-甲醯嗎啉作溶劑,採用轉盤塔。芳烴總收率98.8%,其中苯的收率為100%。
甲苯脫烷基化
甲苯脫烷基製備苯,可以採用催化加氫脫烷基化,或是不用催化劑的熱脫烷基。原料可以用甲苯、及其和二甲苯的混合物,或者含有苯及其他烷基芳烴和非芳烴的餾分。
甲苯催化加氫脫烷基化
用鉻、鉬或氧化鉑等作催化劑,500-600 ℃高溫和400-600個大氣壓的條件下,甲苯與氫氣混合可以生成苯,這一過程稱為加氫脫烷基化作用。如果溫度更高,則可以省去催化劑。反應按照以下方程式進行:
根據所用催化劑和工藝條件的不同又有多種工藝方法:
- Hydeal法:由Ashiand & refing和UOP公司在1961年開發。原料可以是重整油、加氫裂解汽油、甲苯、碳6-碳8混合芳烴、脫烷基煤焦油等。催化劑為氧化鋁-氧化鉻,反應溫度600-650℃,壓力3.43-3.92MPa。苯的理論收率為98%,純度可達99.98%以上,質量優於Udex法生產的苯。
- Detol法:Houdry公司開發。用氧化鋁和氧化鎂做催化劑,反應溫度540-650℃,反應壓力0.69-5.4MPa,原料主要是碳7-碳9芳烴。苯的理論收率為97%,純度可達99.97%。
- Pyrotol法:Air products and chemicals公司和Houdry公司開發。適用於從乙烯副產裂解汽油中制苯。催化劑為氧化鋁-氧化鉻,反應溫度600-650℃,壓力0.49-5.4MPa。
- Bextol法:殼牌公司開發。
- BASF法:BASF公司開發。
- Unidak法:UOP公司開發。
甲苯熱脫烷基化
甲苯在高溫氫氣流下可以不用催化劑進行脫烷基製取苯。反應為放熱反應,針對遇到的不同問題,開發出了多種工藝過程。
- MHC加氫脫烷基過程:由日本三菱石油化學公司和千代田建設公司在1967年開發。原料可以用甲苯等純烷基苯,含非芳烴30%以內的芳烴餾分。操作溫度500-800℃,操作壓力0.98MPa,氫/烴比為1-10。過程選擇性97-99%(mol),產品純度99.99%。
- HDA加氫脫烷基過程:由美國Hydrocarbon Research和Atlantic Richfield公司在1962年開發。原料採用甲苯,二甲苯,加氫裂解汽油,重整油。從反應器不同部位同如氫氣控制反應溫度,反應溫度600-760℃,壓力3.43-6.85MPa,氫/烴比為1-5,停留時間5-30秒。選擇性95%,收率96-100%。
- Sun過程:由Sun Oil公司開發
- THD過程:Gulf Research and Development公司開發
- Monsanto過程:孟山都公司開發
甲苯歧化和烷基轉移
隨著二甲苯用量的上升,在1960年代末相繼開發出了可以同時增產二甲苯的甲苯歧化和烷基轉移技術,主要反應為:
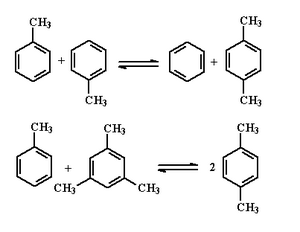
這個反應為可逆反應,根據使用催化劑、工藝條件、原料的不同而有不同的工藝過程。
- LTD液相甲苯歧化過程:美國美孚化學公司在1971年開發,使用非金屬沸石或分子篩催化劑,反應溫度260-315℃,反應器採用液相絕熱固定床,原料為甲苯,轉化率99%以上
- Tatoray過程:日本東麗公司和UOP公司1969年開發,以甲苯和混合碳9芳烴為原料,催化劑為絲光沸石,[13]反應溫度350-530℃,壓力2.94MPa,氫/烴比5-12,採用絕熱固定床反應器,單程轉化率40%以上,收率95%以上,選擇性90%,產品為苯和二甲苯混合物。
- Xylene plas過程:由美國Atlantic Richfield公司和Engelhard公司開發。使用稀土Y型分子篩做催化劑,反應器為氣相移動床,反應溫度471-491℃,常壓。
- TOLD過程:日本三菱瓦斯化學公司1968年開發,氫氟酸-氟化硼催化劑,反應溫度60-120℃,低壓液相。有一定腐蝕性。
其他方法
此外,苯還可以通過乙炔三聚得到,但產率很低。具體的做法是,將乙炔通過高溫石英管(500℃)。反應方程式如下:
此反應實則為狄爾斯-阿爾德反應。
分析測試方法
氣相色譜和液相色譜可以檢測各種產品中苯的含量。苯的純度的測定一般使用冰點法。
對空氣中微量苯的檢測,可以用甲基矽油等有揮發性的有機溶劑或者低分子量的聚合物吸收,然後通過色譜進行分析;或者採用比色法分析;也可以將含有苯的空氣深度冷凍,將苯冷凍下來,然後把硫酸鐵和過氧化氫溶液加入得到黃褐色或黑色沉澱,再用硝酸溶解,然後通過比色法分析。或者直接用硝酸吸收空氣中的苯,硝化成間二硝基苯,然後用二氯化鈦溶液滴定,或者用間二甲苯配製的甲乙酮鹼溶液比色定量。
安全
毒性
由於苯的揮發性大,暴露於空氣中很容易擴散。人和動物吸入或皮膚接觸大量苯進入體內,會引起急性和慢性苯中毒。有研究報告表明,引起苯中毒的部分原因是在體內苯被轉化為苯酚。
苯對中樞神經系統會產生麻痹作用,從而引起急性中毒。重者會出現頭痛、噁心、嘔吐、神志模糊、知覺喪失、昏迷、抽搐等症狀,嚴重者會因為中樞系統麻痹而死亡。少量苯也能使人產生睡意、頭昏、心率加快、頭痛、顫抖、意識混亂、神志不清等現象。攝入含苯過多的食物會導致嘔吐、胃痛、頭昏、失眠、抽搐、心率加快等症狀,甚至死亡。吸入20000ppm的苯蒸氣5-10分鐘便會有致命危險。
長期接觸苯會對血液造成極大傷害,引起慢性中毒,引起神經衰弱綜合症。苯可以損害骨髓,使紅血球、白血球、血小板數量減少,並使染色體畸變,從而導致白血病,甚至出現再生障礙性貧血。苯可以導致大量出血,從而抑制免疫系統的功用,使疾病有機可乘。有研究報告指出,苯在體內的潛伏期可長達12-15年。
婦女吸入過量苯後,會導致月經不調達數月,卵巢會縮小。苯對胎兒發育和對男性生殖力的影響尚未明了。孕期動物吸入苯後,會導致幼體的重量不足、骨骼延遲發育、骨髓損害。
苯對皮膚、黏膜有刺激作用。國際癌症研究中心(IARC)已經確認苯為致癌物。[14][15]
接觸限值:
毒性:
- LD50: 930 mg/kg(大鼠經口);48 mg/kg(小鼠經皮)
- LC50: 10000ppm 7小時(大鼠吸入)
當然,由於每個人的健康狀況和接觸條件不同,對苯的敏感程度也不相同。嗅出苯的氣味時,它的濃度大概是1.5ppm,這時就應該注意到中毒的危險。在檢查時,通過尿和血液的檢查可以很容易查出苯的中毒程度。
代謝
苯主要通過呼吸道吸入(47-80%)、胃腸及皮膚吸收的方式進入人體。一部分苯可通過尿液排出,未排出的苯則首先在肝中細胞色素P450單加氧酶作用下被氧分子氧化為環氧苯(7-氧雜雙環[4.1.0]庚-2,4-二烯)。環氧苯與它的重排產物氧雜環庚三烯存在平衡,是苯代謝過程中產生的有毒中間體。接下來有三種代謝途徑:與穀胱甘肽結合生成苯巰基尿酸;繼續代謝為苯酚、鄰苯二酚、對苯二酚、偏苯三酚、鄰苯醌、對苯醌等,以葡萄糖苷酸或硫酸鹽結合物形式排出;以及被氧化為已二烯二酸。
可燃性
由於苯可以在空氣中燃燒,因此它一般都被定為危險品。例如在中華人民共和國國家標準《危險貨物品名表》(GB 12268-90)中,苯屬第三類危險貨物易燃液體中的中閃點液體。[16]而且由於它的揮發性,可能造成蒸氣局部聚集,因此在貯存、運輸時一般都要求遠離火源和熱源,防止靜電。
由於苯的冰點比較高(5.5℃),在寒冷天氣中運輸會有困難,但是加熱熔化會帶來危險性。
工業用途
早在1920年代,苯就已是工業上一種常用的溶劑,主要用於金屬脫脂。由於苯有毒,人體能直接接觸溶劑的生產過程現已不用苯作溶劑。
苯有減輕爆震的作用而能作為汽油添加劑。在1950年代四乙基鉛開始使用以前,所有的抗爆劑都是苯。然而現在隨著含鉛汽油的淡出,苯又被重新起用。由於苯對人體有不利影響,對地下水質也有污染,歐美國家限定汽油中苯的含量不得超過1%。至2011年時,美國國家環境保護局將進一步收緊限制,令汽油的苯含量上限進一步降低至0.62%。[17]
苯在工業上最重要的用途是做化工原料。苯可以合成一系列苯的衍生物:
- 苯與乙烯生成乙苯,後者可以用來生產制塑料的苯乙烯;
- 與丙烯生成異丙苯,後者可以經異丙苯法來生產丙酮與制樹脂和粘合劑的苯酚;
- 制尼龍的環己烷;
- 合成順丁烯二酸酐;
- 用於製作苯胺的硝基苯;
- 多用於農藥的各種氯苯;
- 合成用於生產洗滌劑和添加劑的各種烷基苯。
食品中的含量
在若干軟性飲品,如部份汽水、果汁飲品、果汁味飲品、葡萄適中,其中的苯甲酸鹽類防腐劑(包括苯甲酸鈉、苯甲酸鉀、苯甲酸鈣)[18]會跟維他命C(抗壞血酸)或異抗壞血酸發生化學作用,脫羧,形成少量的致癌物質苯。該反應在光照或加熱時加速進行。多數飲料中,苯的含量都在10μg/kg以下,符合世界衛生組織的標準(10ppb),但高於美國(5ppb)[19]、加拿大(5ppb)和歐盟(1ppb)[20]的標準。有少量飲料含有較高含量的苯,含量最高的可達87.9ppb,但與日常生活中吸入的苯含量相比,這個數值仍然較小。例如,人每天吸入的潔淨空氣中約含苯220μg;人開車一小時會吸入40μg的苯;每天吸20支煙的人約會吸入7900μg的苯(歐盟估計值),通過被動吸菸吸入的苯也有63μg。[21]
2008年,可口可樂公司宣布,將逐漸在其飲料中(除芬達外)禁止苯甲酸鈉的使用。[22][23]
苯的異構體
苯的衍生物
下面是一些有代表性的苯的取代物或與苯結構相似的物質。
取代苯
多環芳烴
參見
參考文獻
引用
- ^ David R. Lide, ed. "Physical Constants of Organic Compounds", in CRC Handbook of Chemistry and Physics, Internet Version 2005, <http://www.hbcpnetbase.com>. CRC Press.
- ^ Arnold, D.; Plank, C.; Erickson, E.; Pike, F. Solubility of Benzene in Water.. Industrial & Engineering Chemistry Chemical & Engineering Data Series. 1958, 3: 253. doi:10.1021/i460004a016.
- ^ Breslow, R; Guo, T. Surface tension measurements show that chaotropic salting-in denaturants are not just water-structure breakers.. Proceedings of the National Academy of Sciences of the United States of America. 1990, 87 (1): 167–9. PMC 53221
 . PMID 2153285. doi:10.1073/pnas.87.1.167.
. PMID 2153285. doi:10.1073/pnas.87.1.167.
- ^ A. Kayode Coker, Ernest E. Ludwig. Ludwig's applied process design for chemical and petrochemical plants, Volume 1. Elsevier. 2007: 114 [2010-09-13]. ISBN 075067766X. (原始內容存檔於2020-11-15).
- ^ 苯萘蒽菲:有机化合物的中文命名. [2019-01-24]. (原始內容存檔於2021-05-10).
- ^ M. Faraday. On New Compounds of Carbon and Hydrogen, and on Certain Other Products Obtained during the Decomposition of Oil by Heat. Philosophical Transactions of the Royal Society of London. 1825, 115: 440–466. doi:10.1098/rstl.1825.0022.
- ^ R. Kaiser. Bicarburet of Hydrogen. Reappraisal of the Discovery of Benzene in 1825 with the Analytical Methods of 1968. Angewandte Chemie International Edition in English. 1968, 7 (5): 345–350. doi:10.1002/anie.196803451.
- ^ E. Mitscherlich. Ueber das Benzol und die Säuren der Oel- und Talgarten. Annalen der Pharmacie. 1834, 9 (1): 39–48. doi:10.1002/jlac.18340090103.
- ^ 9.0 9.1 凯库勒的梦中发现之谜. [2009-01-26]. (原始內容存檔於2020-11-07).
- ^ Friedel, C.; Crafts, J. M. Compt. Rend. 1877, 84, 1392 (頁面存檔備份,存於網際網路檔案館) & 1450 (頁面存檔備份,存於網際網路檔案館).
- ^ Biphenyl(1,1- Biphenyl). Wiley/VCH, Weinheim (1991), ISBN 978-3-527-28277-7
- ^ 12.0 12.1 曾昭瓊。有機化學.ISBN 978-7-04-013845-0
- ^ 謝在庫,陳慶齡,張成芳. 甲苯歧化工藝及催化劑研究進展. 化工進展. 1999, 第2期 [2009-02-20]. (原始內容存檔於2016-03-12).
- ^ Huff J. Benzene-induced cancers: abridged history and occupational health impact. Int J Occup Environ Health. Apr–Jun 2007, 13 (2): 213–21. PMID 17718179.
- ^ Rana SV; Verma Y. Biochemical toxicity of benzene. J Environ Biol. April 2005, 26 (2): 157–68. PMID 16161967.
- ^ 中閃點液體列表 (頁面存檔備份,存於網際網路檔案館) - 中華人民共和國《危險貨物品名表》(GB 12268-90)
- ^ Control of Hazardous Air Pollutants From Mobile Sources. U.S. Environmental Protection Agency: 15853. 2006-03-29 [2008-06-27]. (原始內容存檔於2008-12-05).
- ^ LK Gardner, GD Lawrence, Benzene Production from Decarboxylation of Benzoic Acid in the Presence of Ascorbic Acid and a Transition-Metal Catalyst, Journal of Agricultural and Food Chemistry, May 1993, Volume 41, Number 5; first page (頁面存檔備份,存於網際網路檔案館)
- ^ United States Food and Drug Administration: Questions and Answers on the Occurrence of Benzene in Soft Drinks and Other Beverages 網際網路檔案館的存檔,存檔日期2008-03-26.
- ^ Council Directive 98/83/EC of 3 November 1998 on the quality of water intended for human consumption Archived 2010-09-17 at WebCite(PDF)
- ^ New Zealand Food Safety Authority / Te Pou Oranga kai O Aotearoa Benzene in flavoured drinks 網際網路檔案館的存檔,存檔日期2007-04-23.
- ^ Martin Hickman Coca-Cola to phase out use of controversial additive after DNA damage claim 網際網路檔案館的存檔,存檔日期2010-04-23. The Independent 25 May 2008
- ^ [Benzene字典-Guidechem.com(英文). [2011-12-29]. (原始內容存檔於2021-05-10). Benzene字典-Guidechem.com(英文)]
書籍
- 魏文德主編,《有機化工原料大全》第三卷,化學工業出版社,1994年,p358-381,ISBN 978-7-5025-0684-1
- [英]漢考克(Hancock, E.G.)主編,《苯及其工業衍生物》,化學工業出版社,1982.11
- Wilson, L. D. "Health Hazards from aromatic Hydrocarbons", Des Plaines, III., Universal Oil Products Company, 1962
- 尹冬冬主編,《有機化學》上冊,高等教育出版社,2003年,ISBN 978-7-04-011055-5
其他
- 中國石化北京化工研究院,《常用危險化學品安全數據卡》(內部材料),2004年
外部連結
- Benzene Material Safety Data Sheet
- Chemistry WebBook上的化學性質數據 (頁面存檔備份,存於網際網路檔案館)
- 職業性苯中毒診斷標準——GBZ68-2002
- 化工世界苯網——提供苯的市場行情