異喹啉
| 異喹啉 | |
|---|---|

| |

| |
| IUPAC名 Isoquinoline | |
| 別名 | 苯並[c]吡啶 |
| 識別 | |
| CAS編號 | 119-65-3 |
| PubChem | 8405 |
| ChemSpider | 8098 |
| SMILES |
|
| InChI |
|
| InChIKey | AWJUIBRHMBBTKR-UHFFFAOYAX |
| EINECS | 204-341-8 |
| ChEBI | 16092 |
| DrugBank | DB04329 |
| 性質 | |
| 化學式 | C9H7N |
| 摩爾質量 | 129.16 g·mol⁻¹ |
| 外觀 | 無色片狀低熔點固體 |
| 密度 | 1.099 g/cm³ |
| 熔點 | 26~28 °C |
| 沸點 | 242 °C |
| 溶解性(水) | 微溶於水 |
| 蒸氣壓 | 5 Pa (20°C) |
| 折光度n D |
1.62078 (30°C) |
| 危險性 | |
| 歐盟危險性符號 | |
| 警示術語 | R:R22, R24 |
| 安全術語 | S:S24/25, S36/37, S45 |
| 閃點 | 107 °C |
| 致死量或濃度: | |
LD50(中位劑量)
|
360 mg/kg(大鼠,口服)[1] 180 mg/kg(大鼠,皮膚) |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
異喹啉(英語:Isoquinoline)是由萘中的一個 β-CH 基團被氮替換衍生出來的雜環化合物,與喹啉互為同分異構體,有芳香性。
物理性質
[編輯]異喹啉是無色低熔點片狀結晶、固體或液體,有類似茴香油和苯甲醛混合物的香味,通常存放後顏色會發黃。存在於煤焦油和骨油中。微溶於水,溶於稀酸,能與多種有機溶劑混溶。能隨水蒸氣蒸發。具吸水性。有鹼性,pKa = 5.4,鹼性較喹啉強,比吡啶略強,能與各種酸成鹽,其鹽酸鹽熔點 209°C。
歷史
[編輯]1885年 Hoogewerff 和 van Dorp[2]從煤焦油喹啉餾分中用分級結晶法獲得了硫酸異喹啉。同年 Gabriel[3]完成了異喹啉的合成。1914年 Weißgerber[4]利用異喹啉和喹啉之間的鹼性差異,發展了一種更為有效的分離方法。
生產
[編輯]工業上主要以煤焦油粗喹啉餾分為原料,通過磺化、分級結晶、過濾、重結晶、氨水分解、洗滌和精餾生產異喹啉。
化學性質
[編輯]異喹啉的化學性質與吡啶和喹啉相似,質子化、烷基化、酰化以及被過氧酸氧化都在 N 原子上進行,親電芳香取代和親核芳香取代反應主要在環上的 C 原子上進行。
取代反應
[編輯]異喹啉的親電芳香取代活性高於吡啶,優先發生在異喹啉環的 5- 和 8-位,以 5-位產物為主。[5][6]通過N-質子化進行苯環上C-質子化然後進行質子交換,需要硫酸這樣的強酸,而且反應在 C-5 上比 C-8 上快。[7]親核芳香取代在異喹啉的雜環進行,優先發生在 1-位。例如,異喹啉經過 Chichibabin反應可得1-氨基異喹啉;[8]與正丁基鋰發生 Ziegler反應得到1-正丁基異喹啉,這個反應的一級加成產物1-正丁基-1,2-二氫異喹啉受稠合苯環的影響而得到穩定,可被分離出來,經硝基苯氧化可在碳上取代,並恢復異喹啉環的芳香性。
異喹啉可以在高溫下通入氫氣流與氫氧化鉀反應而直接羥基化,產物是1-異喹啉酮。[9]
異喹啉 3-位的鹵素表現出與鹵代苯相似的性質,但 1-位的鹵素具有與 α- 和 γ-鹵代吡啶相似的敏感性,很容易發生親核芳香取代。例如,1,3-二氯異喹啉可選擇性地被甲氧基取代為 1-甲氧基-3-氯異喹啉。然而,3-鹵代異喹啉惰性的一個明顯例外是 3-溴代異喹啉與氨基鈉通過ANRORC機理發生的取代反應,在這個反應中環氮原子變為取代基上的氮原子,生成3-氨基異喹啉。[10]
異喹啉在苯甲酰氯等酰化試劑的作用下,與氰化鉀或三甲基氰矽烷發生 Reissert反應,生成 Reissert 化合物 2-酰基-1-氰基-1,2-二氫異喹啉。Reissert 化合物可以發生一系列在合成上有用的轉換。[11][12]
異喹啉可以與過氧化苯甲酰作用,生成多種苯基異喹啉的混合物。如果用異喹啉正離子為作用物,則可通過它在酸性溶液中與親核性更強的自由基的取代反應,在異喹啉的 1-位引入酰基和酰氨基。
氧化還原反應
[編輯]異喹啉被鹼性高錳酸鉀氧化,兩個環都可被降解,得到的是吡啶-3,4-二甲酸和鄰苯二甲酸的混合物。[13]而在中性介質中用高錳酸鉀氧化,不氧化苯環,只生成鄰苯二甲酰亞胺。苯環上的取代基可以影響氧化反應的結果。
異喹啉可以被催化氫化、氫化試劑或金屬還原;也可以實現選擇性完全還原或部分還原異喹啉的吡啶環或苯環。催化氫化的產物受反應介質酸性的影響很大:在乙酸中,吡啶環選擇性還原生成1,2,3,4-四氫異喹啉;而在濃鹽酸中,苯環被選擇性還原生成5,6,7,8-四氫異喹啉,進一步還原則生成順式和反式十氫異喹啉的混合物。
異喹啉用二乙基氫化鋁或氫化鋁鋰[14]還原可以得到很活潑的1,2-二氫異喹啉;在液氨中用鋰還原則得到3,4-二氫異喹啉[15]。異喹啉鎓離子被質子溶劑中的硼氫化鈉迅速還原生成1,2,3,4-四氫異喹啉,該反應是確定生物鹼結構的一個重要反應。雜環部分迅速被還原,其它可被還原的官能基如羰基可以不受影響。
其他反應
[編輯]異喹啉雜環上的甲基具有 CH 酸性,1-位甲基氫酸性大於3-位,因此能夠發生酸或鹼催化的 C-C 鍵形成反應。
異喹啉鎓鹽中的吡啶鎓環較容易進行親核加成,可與富電子的親雙烯體如乙烯基乙醚發生環加成反應。[16]
合成
[編輯]
從異喹啉 1 的逆合成分析可以看出,如果從亞胺鍵的斷裂回推,可以通過二羰基化合物 10 作為環合原料。如果算上還原步驟,可用氨基羰基化合物 8 和 4 作為二氫異喹啉的製取原料。另一方面,3,4-二氫異喹啉 5 的 C-1 和 C-4 鍵斷裂可以產生合成子 α-親電性烯胺 7 以及 β-親電性烯胺 6,它們也可用作親電芳香取代環化的原料。
因此,異喹啉及其衍生物的合成方法有:
1、(2-甲酰苯基)乙醛及類似的二羰基化合物與氨發生環化反應生成異喹啉(合成子 10)。如果用羥胺、肼或一級胺代替氨,則可分別得到異喹啉N-氧化物、N-內銨鹽和N-取代的異喹啉鎓離子。
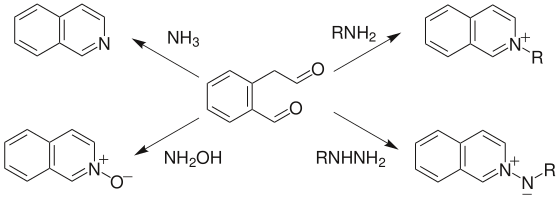
2、Bischler-Napieralski反應:2-芳基乙胺與酰氯或酸酐反應生成酰胺,然後在失水劑作用下環化生成3,4-二氫異喹啉,然後脫氫生成1-取代的異喹啉(合成子 7)。
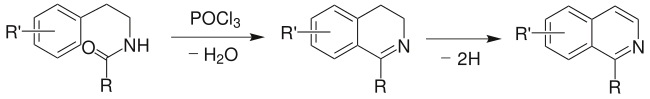
Pictet-Gams反應:上述反應的改進法,用 β-甲氧基或 β-羥基芳乙胺進行反應,可不經氧化或脫氫,直接得到異喹啉類化合物。反應中有噁唑啉中間體生成。
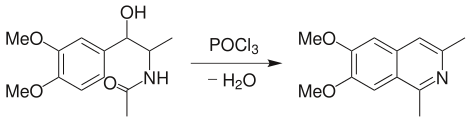
3、Pictet-Spengler反應:2-芳基乙胺與醛在酸催化下生成亞胺,然後亞胺在酸催化下環化生成1,2,3,4-四氫異喹啉,脫氫得到異喹啉(合成子 7)。

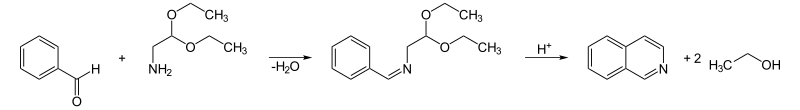
4、Pomeranz-Fritsch合成:芳醛與氨基乙縮醛縮合生成亞胺,亞胺在酸催化下環化為雜環上無取代基的異喹啉(合成子 6)。
用途
[編輯]用作合成藥物、染料、殺蟲劑的中間體及氣相色譜固定液。
異喹啉衍生物廣泛存在於自然界中,[17]目前已知的異喹啉生物鹼有1000多種,是已知生物鹼中最大的一類。它們多以異喹啉或四氫異喹啉為母核,又可根據連接基團而細分為異喹啉類、苯甲基異喹啉類、雙苯甲基異喹啉類、阿撲芬類、原小檗鹼類、普羅托品類、吐根鹼類、α-萘菲啶類和嗎啡類生物鹼等九類。
有許多藥物是異喹啉的衍生物。著名的異喹啉類生物鹼罌粟鹼,至今仍是重要的解痙藥。抗抑鬱藥諾米芬辛和抗血吸蟲藥吡喹酮是從四氫異喹啉衍生而來。
內文註釋
[編輯]- ^ Smyth et al., Arch. Ind. Hyg. Occup. Med. 4, 119 (1951)
- ^ S. Hoogewerff and W. A. van Dorp, Rec. Trav. Chim. Pays-Bas, 4, 125 (1885).
- ^ S. Gabriel. Synthese von Derivaten des Isochinolins. Berichte der deutschen chemischen Gesellschaft. 1885, 18 (2): 3470–3480. doi:10.1002/cber.188501802334.
- ^ R. Weißgerber. Über das Isochinolin im Steinkohlenteer. Berichte der deutschen chemischen Gesellschaft. 1914, 47 (3): 3175–3181. doi:10.1002/cber.191404703123.
- ^ M. J. S. Dewar and P. M. Maitlis. Electrophilic substitution. Part XI. Nitration of some six-membered nitrogen-heterocyclic compounds in sulphuric acid. J. Chem. Soc. 1957: 2521–2528. doi:10.1039/JR9570002521.
- ^ J. A. Beisler. A short synthesis of several gambir alkaloids. Tetrahedron. 1970, 26 (8): 1961–1965. doi:10.1016/S0040-4020(01)92772-3.
- ^ U. Bressel, A. R. Katritzky and J. R. Lea. Kinetics and mechanism of electrophilic substitution of heteroaromatic compounds. Part XXIII. Acid-catalysed hydrogen exchange of quinoline, isoquinoline, and their N-oxides. J. Chem. Soc. (B). 1971: 4–10. doi:10.1039/J29710000004.
- ^ F. W. Bergstrom. Die direkte Einführung von Aminogruppen in den aromatischen und heterocyclischen Ring. II. Die Reaktion von Iso-chinolin mit Alkali- und Erdalkali-amiden in flüssigem Ammoniak. Justus Liebigs Ann. Chem. 1935, 515 (1): 34–42. doi:10.1002/jlac.19355150105.
- ^ Jan J. M. Vandewalle, Ernest de Ruiter, Hans Reimlinger, René A. Lenaers. Notiz über eine verbesserte Darstellung von Isocarbostyril und Carbostyril. Chemische Berichte. 1975, 108 (12): 3898–3899. doi:10.1002/cber.19751081223.
- ^ Sanders, G. M., van Dijk, M., and den Hertog, H. J., Recl. Trav. Chim. Pays-Bas, 93, 198 (1974).
- ^ Frank D. Popp, John M. Wefer. Reissert compound studies. XV. preparation and reaction of the reissert anion at room temperature. J. Heterocycl. Chem. 1967, 4 (2): 183–187. doi:10.1002/jhet.5570040204.
- ^ Jung-Tai Hahn, Joydeep Kant, Frank D. Popp, Siri Ram Chhabra, Barrie C. Uff. Reissert compound studies. LXV. Preparation of reissert compounds derived from α,β-unsaturated acid chlorides. J. Heterocycl. Chem. 1992, 29 (5): 1165–1176. doi:10.1002/jhet.5570290521.
- ^ S. Hoogewerff, W. A. van Dorp. Sur les Produits de l'oxydation de l'isoquinoléine par le permanganate de potassium. Rec. Trav. Chim. Pays-Bas. 1885, 4: 285–293.
- ^ Jackman, L. M. and Packham, D. I., Chem. Ind. (London), 1955, 360.
- ^ Walter Hückel, Gerhard Graner. Reduktionen in flüssigem Ammoniak, XI. Isochinolin. Chemische Berichte. 1957, 90 (9): 2017–2023. doi:10.1002/cber.19570900945.
- ^ F. Howard Day, Charles K. Bradsher, Teh-Kuei Chen. Cycloaddition reactions of some 5-substituted isoquinolinium salts. J. Org. Chem. 1975, 40 (9): 1195–1198. doi:10.1021/jo00897a002.
- ^ Hesse, Manfred. Alkaloide 1st ed. Weinheim: Wiley-VHC. 2000. ISBN 978-3-906390-19-2.
參考資料
[編輯]- T. Eicher, S. Hauptmann 著,李潤濤、葛澤梅、王欣 譯. 杂环化学——结构、反应、合成与应用(The Chemistry of Heterocycles: Structures, Reactions, Synthesis and Applications) 第二版. 北京: 化學工業出版社. 2005年11月: 287–298. ISBN 7-5025-7960-5.
- J. A. Joule, K. Mills 著,由業誠、高大彬等譯. 杂环化学(Heterocyclic Chemistry) 4th ed. 北京: 科學出版社. 2004年7月: 131–163. ISBN 7-03-012736-6.
- 陳敏為,甘禮騅. 有机杂环化合物 第一版. 北京: 高等教育出版社. 1990年6月: 102–119. ISBN 7-04-001122-0.
- T. Kametani, Edited by John ApSimon. The Total Synthesis of Isoquinoline Alkaloids. from "The Total Synthesis of Natural Products", Volume 3. Toronto: John Wiley & Sons, Inc. 1977: 3–251. ISBN 0-471-02392-2.
- 徐仁生主編,葉陽、趙維民副主編. 《天然产物化学》(第二版). 北京: 科學出版社. 2004年9月: 115–127. ISBN 7-03-012518-5.

