TEV蛋白酶
| TEV蛋白酶 | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
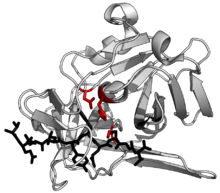
| TEV蛋白酶(白色)與肽底物(黑色)與活性位點三聯體殘基(紅色)複合。 (PDB 1lvb) | |||||||
| |||||||
| 識別碼 | |||||||
| EC編號 | 3.4.22.44 | ||||||
| CAS號 | 139946-51-3 | ||||||
| 資料庫 | |||||||
| IntEnz | IntEnz瀏覽 | ||||||
| BRENDA | BRENDA入口 | ||||||
| ExPASy | NiceZyme瀏覽 | ||||||
| KEGG | KEGG入口 | ||||||
| MetaCyc | 代謝路徑 | ||||||
| PRIAM | 概述 | ||||||
| PDB | RCSB PDB PDBj PDBe PDBsum | ||||||
| |||||||
菸草蝕刻病毒蛋白酶Tobacco Etch Virus protease(EC 3.4.22.44),簡稱TEV蛋白酶,是來自菸草蝕刻病毒的高度序列特異性半胱氨酸蛋白酶。[1]它是胰凝乳蛋白酶樣蛋白酶PA家族的成員。[2]由於其高序列特異性,它經常用於體外和體內融合蛋白的受控切割。[3]
來源
[編輯]菸草蝕刻病毒將其整個基因組編碼為單一的大量多聚蛋白(350kDa)。這被三種蛋白酶切割成功能單元:P1蛋白酶(1個切割位點)、輔助組分蛋白酶(1個切割位點)和TEV蛋白酶(7個切割位點)。[1]天然TEV蛋白酶還包含一個內部自切割位點。該位點被緩慢切割以使酶失活(其生理原因尚不清楚)。
結構和作用方式
[編輯]
TEV蛋白酶的結構已通過X射線晶體學解析。[4]它由兩個β桶和一個靈活的C末端尾部組成,並顯示出與蛋白酶的糜蛋白酶超家族(PA 族,MEROPS 分類的 C4 家族)的結構同源性。[2]儘管與細胞絲氨酸蛋白酶(如胰蛋白酶、彈性蛋白酶、凝血酶等)同源,但TEV蛋白酶使用半胱氨酸作為其催化親核試劑[5](與許多其他病毒蛋白酶一樣)。
用Asp-His-Cys三聯體進行共價催化,在兩個桶之間分開(β1上的Asp與β2上的His和Cys)。[6]底物保持為β摺疊,與桶之間的裂縫形成反平行相互作用,並與C端形成平行相互作用。[7]因此,酶在底物周圍形成結合隧道,側鏈相互作用控制特異性。[4]
特異性
[編輯]
優選的天然切割序列首先通過檢查天然多蛋白底物中的切割位點的重複序列來鑑定。這些天然切割位點的共識是ENLYFQ\S,其中「\」表示切割的肽鍵。[8]底物的殘留物在切割位點之前標記為P6到P1,在切割位點之後標記為P1'。早期的工作還測量了一系列相似底物的切割,以表徵蛋白酶對天然序列的特異性。[9][10]
隨後的研究使用從隨機序列池中切割底物的測序來確定偏好模式。[11][12]儘管ENLYFQ\S是最佳序列,但蛋白酶在一系列底物上或多或少都有活性(即顯示出一些底物混雜)。最高切割是最接近共有EXLYΦQ\φ的序列,其中X是任何殘基,Φ是任何大或中等疏水基,φ是任何小的疏水或極性殘基。雖然這個序列是最優的,但如果序列的其餘部分是最優的,那麼在某些位置具有不利殘基的序列仍然可以被切割。[10][12]
酶和底物之間的大接觸面積賦予了特異性。由於只有一個或兩個口袋結合底物側鏈的淺結合裂口,蛋白酶(如胰蛋白酶)對斷裂鍵前後的一個殘基具有特異性。相反,病毒蛋白酶(如TEV蛋白酶)有一個長的C端,它完全覆蓋底物以形成結合隧道。該隧道包含一組緊密的結合口袋,這樣底物肽的每個側鏈(P6到P1')都結合在一個互補位點(S6到S1')。[4]
特別是,肽側鏈P6-Glu接觸三個氫鍵網絡;P5-Asn指向溶劑,沒有特定的相互作用(因此在這個位置沒有底物共識);P4-Leu被埋在疏水袋中; P3-Tyr位於末端帶有短氫鍵的疏水袋中;P2-Phe也被疏水物包圍,包括三聯體組氨酸的表面;P1-Gln形成四個氫鍵;並且P1'-Ser僅部分封閉在淺疏水凹槽中。[4]
作為生化工具
[編輯]這種蛋白質的主要用途之一是從純化的重組融合蛋白中去除親和標籤。使用TEV蛋白酶作為生化工具的原因是其高序列特異性。當偏好序列插入柔性環時,這種特異性允許蛋白質的受控切割。它還使其在體內相對無毒,因為識別的序列幾乎不存在於蛋白質中。[13]
儘管合理設計在改變蛋白酶特異性方面的成功有限,但定向進化已被用於在切割位點之前[14]或之後[15][16]改變首選殘基。
然而,TEV蛋白酶作為生化工具確實有局限性。它很容易通過自切割(自溶)失活,儘管這可以通過內部切割位點的單個S219V突變來消除。[17]單獨表達的蛋白酶的溶解性也很差,但是已經進行了幾次嘗試以通過定向進化和計算設計來提高其溶解度。還表明,可以通過與麥芽糖結合蛋白融合來改善表達,該蛋白充當溶解度增強夥伴。
據報道,TEV蛋白酶在4°C時活性降低10倍。[18]TEV蛋白酶在34°C以上的溫度下會失去活性。[19]
這種酶的分子量在25和27 kDa之間變化,具體取決於所使用的特定構建體。
參考文獻
[編輯]- ^ 1.0 1.1 UniProt: TEV polyprotein: P04517. [2022-09-21]. (原始內容存檔於2022-12-01).
- ^ 2.0 2.1 Rawlings ND, Barrett AJ, Bateman A. MEROPS: the database of proteolytic enzymes, their substrates and inhibitors. Nucleic Acids Res. January 2012, 40 (Database issue): D343–50. PMC 3245014
 . PMID 22086950. doi:10.1093/nar/gkr987.
. PMID 22086950. doi:10.1093/nar/gkr987.
- ^ Kapust RB, Waugh DS. Controlled intracellular processing of fusion proteins by TEV protease. Protein Expr. Purif. July 2000, 19 (2): 312–8. PMID 10873547. doi:10.1006/prep.2000.1251.
- ^ 4.0 4.1 4.2 4.3 Phan J, Zdanov A, Evdokimov AG, Tropea JE, Peters HK, Kapust RB, Li M, Wlodawer A, Waugh DS. Structural basis for the substrate specificity of tobacco etch virus protease. J. Biol. Chem. December 2002, 277 (52): 50564–72. PMID 12377789. doi:10.1074/jbc.M207224200
 .
.
- ^ Bazan JF, Fletterick RJ. Viral cysteine proteases are homologous to the trypsin-like family of serine proteases: structural and functional implications. Proc. Natl. Acad. Sci. U.S.A. November 1988, 85 (21): 7872–6. Bibcode:1988PNAS...85.7872B. PMC 282299
 . PMID 3186696. doi:10.1073/pnas.85.21.7872
. PMID 3186696. doi:10.1073/pnas.85.21.7872  .
.
- ^ Dougherty WG, Parks TD, Cary SM, Bazan JF, Fletterick RJ. Characterization of the catalytic residues of the tobacco etch virus 49-kDa proteinase. Virology. September 1989, 172 (1): 302–10. PMID 2475971. doi:10.1016/0042-6822(89)90132-3.
- ^ Tyndall JD, Nall T, Fairlie DP. Proteases universally recognize beta strands in their active sites. Chem. Rev. March 2005, 105 (3): 973–99. PMID 15755082. doi:10.1021/cr040669e.
- ^ Carrington JC, Dougherty WG. A viral cleavage site cassette: identification of amino acid sequences required for tobacco etch virus polyprotein processing. Proc. Natl. Acad. Sci. U.S.A. May 1988, 85 (10): 3391–5. Bibcode:1988PNAS...85.3391C. PMC 280215
 . PMID 3285343. doi:10.1073/pnas.85.10.3391
. PMID 3285343. doi:10.1073/pnas.85.10.3391  .
.
- ^ Dougherty WG, Cary SM, Parks TD. Molecular genetic analysis of a plant virus polyprotein cleavage site: a model. Virology. August 1989, 171 (2): 356–64. PMID 2669323. doi:10.1016/0042-6822(89)90603-X.
- ^ 10.0 10.1 Kapust, Rachel B.; Tözsér, József; Copeland, Terry D.; Waugh, David S. The P1' specificity of tobacco etch virus protease. Biochemical and Biophysical Research Communications. 2002-06-28, 294 (5): 949–955. CiteSeerX 10.1.1.375.4271
 . ISSN 0006-291X. PMID 12074568. doi:10.1016/S0006-291X(02)00574-0.
. ISSN 0006-291X. PMID 12074568. doi:10.1016/S0006-291X(02)00574-0.
- ^ Boulware KT, Jabaiah A, Daugherty PS. Evolutionary optimization of peptide substrates for proteases that exhibit rapid hydrolysis kinetics. Biotechnol. Bioeng. June 2010, 106 (3): 339–46. PMID 20148412. S2CID 205499859. doi:10.1002/bit.22693.
- ^ 12.0 12.1 Kostallas G, Löfdahl PÅ, Samuelson P. Substrate profiling of tobacco etch virus protease using a novel fluorescence-assisted whole-cell assay. PLOS ONE. 2011, 6 (1): e16136. Bibcode:2011PLoSO...616136K. PMC 3022733
 . PMID 21267463. doi:10.1371/journal.pone.0016136
. PMID 21267463. doi:10.1371/journal.pone.0016136  .
.
- ^ Parks TD, Leuther KK, Howard ED, Johnston SA, Dougherty WG. Release of proteins and peptides from fusion proteins using a recombinant plant virus proteinase. Anal. Biochem. February 1994, 216 (2): 413–7. PMID 8179197. doi:10.1006/abio.1994.1060.
- ^ Yi L, Gebhard MC, Li Q, Taft JM, Georgiou G, Iverson BL. Engineering of TEV protease variants by yeast ER sequestration screening (YESS) of combinatorial libraries. Proc. Natl. Acad. Sci. U.S.A. April 2013, 110 (18): 7229–34. Bibcode:2013PNAS..110.7229Y. PMC 3645551
 . PMID 23589865. doi:10.1073/pnas.1215994110
. PMID 23589865. doi:10.1073/pnas.1215994110  .
.
- ^ Renicke C, Spadaccini R, Taxis C. A tobacco etch virus protease with increased substrate tolerance at the P1' position. PLOS ONE. 2013, 8 (6): e67915. Bibcode:2013PLoSO...867915R. PMC 3691164
 . PMID 23826349. doi:10.1371/journal.pone.0067915
. PMID 23826349. doi:10.1371/journal.pone.0067915  .
.
- ^ Verhoeven KD, Altstadt OC, Savinov SN. Intracellular detection and evolution of site-specific proteases using a genetic selection system. Appl. Biochem. Biotechnol. March 2012, 166 (5): 1340–54. PMID 22270548. S2CID 36583382. doi:10.1007/s12010-011-9522-6.
- ^ Kapust RB, Tözsér J, Fox JD, Anderson DE, Cherry S, Copeland TD, Waugh DS. Tobacco etch virus protease: mechanism of autolysis and rational design of stable mutants with wild-type catalytic proficiency. Protein Eng. December 2001, 14 (12): 993–1000. PMID 11809930. doi:10.1093/protein/14.12.993
 .
.
- ^ Raran-Kurussi S, Tözsér J, Cherry S, Tropea JE, Waugh DS. Differential temperature dependence of tobacco etch virus and rhinovirus 3C proteases. Analytical Biochemistry. 15 May 2013, 436 (2): 142–144. PMC 4196241
 . PMID 23395976. doi:10.1016/j.ab.2013.01.031.
. PMID 23395976. doi:10.1016/j.ab.2013.01.031.
- ^ Nallamsetty S, Kapust RB, Tözsér J, Cherry S, Tropea JE, Copeland TD, Waugh DS. Efficient site-specific processing of fusion proteins by tobacco vein mottling virus protease in vivo and in vitro. Protein Expr. Purif. November 2004, 38 (1): 108–115. PMID 15477088. doi:10.1016/j.pep.2004.08.016.
