Трисульфид тетрафосфора: различия между версиями
Перейти к навигации
Перейти к поиску
| [непроверенная версия] | [отпатрулированная версия] |
Содержимое удалено Содержимое добавлено
Применение |
устаревший шаблон |
||
| Строка 78: | Строка 78: | ||
== Получение == |
== Получение == |
||
* Сплавление фосфора и серы в инертной атмосфере: |
* Сплавление фосфора и серы в инертной атмосфере: |
||
::<math>\mathsf{P + S \ \xrightarrow[CO_2]{250^oC}\ P_4S_n }</math> |
:: <math>\mathsf{P + S \ \xrightarrow[CO_2]{250^oC}\ P_4S_n }</math> |
||
: где ''n'' = 2, 3, 5, 6, 7, 9, 10. Смесь очищают [[Сублимация (физика)|возгонкой]] или [[Перекристаллизация|перекристаллизацией]] в [[сероуглерод]]е. |
: где ''n'' = 2, 3, 5, 6, 7, 9, 10. Смесь очищают [[Сублимация (физика)|возгонкой]] или [[Перекристаллизация|перекристаллизацией]] в [[сероуглерод]]е. |
||
== Физические свойства == |
== Физические свойства == |
||
| ⚫ | |||
| ⚫ | |||
Не растворяется в холодной воде, реагирует с горячей, отлично растворяется в [[сероуглерод]]е. |
Не растворяется в холодной воде, реагирует с горячей, отлично растворяется в [[сероуглерод]]е. |
||
== Химические свойства == |
== Химические свойства == |
||
* При сильном нагревании разлагается на компоненты: |
* При сильном нагревании разлагается на компоненты: |
||
::<math>\mathsf{P_4S_3 \ \xrightarrow{700^oC}\ 4P + 3S }</math> |
:: <math>\mathsf{P_4S_3 \ \xrightarrow{700^oC}\ 4P + 3S }</math> |
||
* Разлагается горячей водой с образованием смеси продуктов: |
* Разлагается горячей водой с образованием смеси продуктов: |
||
::<math>\mathsf{P_4S_3 \ \xrightarrow[-H_2S]{H_2O, 100^oC}\ H_3PO_4, H_2(PHO_3), H(PH_2O_2) }</math> |
:: <math>\mathsf{P_4S_3 \ \xrightarrow[-H_2S]{H_2O, 100^oC}\ H_3PO_4, H_2(PHO_3), H(PH_2O_2) }</math> |
||
* Окисляется горячей концентрированной [[Азотная кислота|азотной кислотой]]: |
* Окисляется горячей концентрированной [[Азотная кислота|азотной кислотой]]: |
||
::<math>\mathsf{P_4S_3 + 38HNO_3 \ \xrightarrow{}\ 4H_3PO_4 + 3H_2SO_4 + 38NO_2\uparrow + 10H_2O }</math> |
:: <math>\mathsf{P_4S_3 + 38HNO_3 \ \xrightarrow{}\ 4H_3PO_4 + 3H_2SO_4 + 38NO_2\uparrow + 10H_2O }</math> |
||
* Реагирует с щелочами с образованием смеси продуктов: |
* Реагирует с щелочами с образованием смеси продуктов: |
||
::<math>\mathsf{P_4S_3 \ \xrightarrow[-Na_2S, -H_2O]{NaOH}\ Na_3PO_4, Na_2(PHO_3), Na(PH_2O_2) }</math> |
:: <math>\mathsf{P_4S_3 \ \xrightarrow[-Na_2S, -H_2O]{NaOH}\ Na_3PO_4, Na_2(PHO_3), Na(PH_2O_2) }</math> |
||
* Окисляется кислородом: |
* Окисляется кислородом: |
||
::<math>\mathsf{P_4S_3 + 3O_2 \ \xrightarrow{}\ 4P_4O_6 + 3S }</math> |
:: <math>\mathsf{P_4S_3 + 3O_2 \ \xrightarrow{}\ 4P_4O_6 + 3S }</math> |
||
::<math>\mathsf{P_4S_3 + 8O_2 \ \xrightarrow{100-300^oC}\ 4P_4O_{10} + 3SO_2 }</math> |
:: <math>\mathsf{P_4S_3 + 8O_2 \ \xrightarrow{100-300^oC}\ 4P_4O_{10} + 3SO_2 }</math> |
||
* В растворе сероуглерода реагирует с серой: |
* В растворе сероуглерода реагирует с серой: |
||
::<math>\mathsf{P_4S_3 + S \ \xrightarrow{h\nu, I_2}\ 4P_4S_5 }</math> |
:: <math>\mathsf{P_4S_3 + S \ \xrightarrow{h\nu, I_2}\ 4P_4S_5 }</math> |
||
== Применение == |
== Применение == |
||
| ⚫ | |||
| ⚫ | |||
== Литература == |
== Литература == |
||
Версия от 05:46, 4 мая 2024
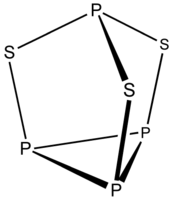
| Трисульфид тетрафосфора | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Тетрафосфора трисульфид |
| Традиционные названия | Сульфид фосфора, сернистый фосфор |
| Хим. формула | P4S3 |
| Физические свойства | |
| Состояние | жёлто-зелёные кристаллы |
| Молярная масса | 220,09 г/моль |
| Плотность | 2,03 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 172,5 °C |
| • кипения | 407,5 °C |
| Мол. теплоёмк. | 162,6 Дж/(моль·К) |
| Энтальпия | |
| • образования | -130 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в сероуглероде | 100 г/100 мл |
| Классификация | |
| Рег. номер CAS | 1314-85-8 |
| PubChem | 14818 |
| Рег. номер EINECS | 215-245-0 |
| SMILES | |
| InChI | |
| RTECS | TH4330000 |
| ChemSpider | 14134 и 21428498 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Трисульфи́д тетрафо́сфора (сесквисульфид фосфора) бинарное неорганическое соединение фосфора и серы с формулой P4S3, жёлто-зелёные кристаллы, не растворяется в холодной воде, реагирует с горячей.
Получение
- Сплавление фосфора и серы в инертной атмосфере:
- где n = 2, 3, 5, 6, 7, 9, 10. Смесь очищают возгонкой или перекристаллизацией в сероуглероде.
Физические свойства
Тетрафосфора трисульфид образует жёлто-зелёные кристаллы ромбической сингонии, пространственная группа P nmb, параметры ячейки a = 1,063 нм, b = 0,969 нм, c = 1,372 нм, Z = 8.
Не растворяется в холодной воде, реагирует с горячей, отлично растворяется в сероуглероде.
Химические свойства
- При сильном нагревании разлагается на компоненты:
- Разлагается горячей водой с образованием смеси продуктов:
- Окисляется горячей концентрированной азотной кислотой:
- Реагирует с щелочами с образованием смеси продуктов:
- Окисляется кислородом:
- В растворе сероуглерода реагирует с серой:
Применение
- Компонент для изготовления «сесквисульфидных спичек», или «бестёрочных» — зажигающихся при трении о любую поверхность, а не только о специальную намазку спичечного коробка́.
Литература
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5. — 783 с. — ISBN 5-85270-310-9.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |
![{\displaystyle {\mathsf {P+S\ {\xrightarrow[{CO_{2}}]{250^{o}C}}\ P_{4}S_{n}}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/e19587e0aa6e33369ee97431d0642212387ca8a1)

![{\displaystyle {\mathsf {P_{4}S_{3}\ {\xrightarrow[{-H_{2}S}]{H_{2}O,100^{o}C}}\ H_{3}PO_{4},H_{2}(PHO_{3}),H(PH_{2}O_{2})}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/2fdfa3b64be406ff07a5888d86332cd11a60ead0)

![{\displaystyle {\mathsf {P_{4}S_{3}\ {\xrightarrow[{-Na_{2}S,-H_{2}O}]{NaOH}}\ Na_{3}PO_{4},Na_{2}(PHO_{3}),Na(PH_{2}O_{2})}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/65fa717e227f4598581f4fff90b2812e706c9e01)


