轮状病毒
| 轮状病毒 | |
|---|---|

| |
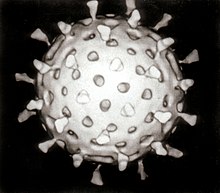
| 轮状病毒的电子显微镜影像 黑线长度 = 100 nm | |
| 科学分类 | |
| (未分级): | 病毒 Virus |
| 域: | 核糖病毒域 Riboviria |
| 界: | 正核糖病毒界 Orthornavirae |
| 门: | 双链RNA病毒门 Duplornaviricota |
| 纲: | 呼肠孤病毒纲 Resentoviricetes |
| 目: | 呼肠孤病毒目 Reovirales |
| 科: | 呼肠孤病毒科 Reoviridae |
| 亚科: | 无刺突呼肠孤病毒亚科 Sedoreovirinae |
| 属: | 轮状病毒属 Rotavirus |
| 种 | |
| |
| 轮状病毒肠胃炎 Rotaviral Gastroenteritis | |
|---|---|
| 分类和外部资源 | |
| ICD-11 | XN6N7 |
| ICD-10 | A08.0 |
| ICD-9-CM | 008.61 |
| DiseasesDB | 11667 |
| MedlinePlus | 000252 |
| eMedicine | emerg/401 |
| MeSH | D012400 |
轮状病毒(Rotavirus,简称RV)是一种双链核糖核酸病毒,属于呼肠孤病毒科。它是引起婴幼儿腹泻的最常见原因[1],几乎每个儿童在约五岁时都经历至少一次轮状病毒感染[2]。然而,每一次感染后人体免疫力会逐渐增强,因此之后再次感染的影响就会减轻[3],到成人阶段就很少受其影响[4]。轮状病毒总共有八个种,以英文字母编号为A、B、C、D、E、F、G与H。其中,A种是最为常见的一种,超过90%人类轮状病毒感染是由该种造成。
轮状病毒是借由粪口途径传染的。它会感染与小肠壁上的肠黏膜细胞并且产生肠毒素(enterotoxin),肠毒素会引起肠胃炎,导致严重的腹泻,有时候甚至会因为脱水而导致死亡。虽然轮状病毒于1973年就被由澳洲的露丝·毕夏普所发现[5],而且造成婴儿与幼儿总计超过50%以上因为严重腹泻而住院治疗的案例[6],但是在公共卫生社群中它仍然没有被广泛地重视,特别是在发展中国家更是如此[7]。除了对人类健康的影响之外,轮状病毒也会感染动物,是家畜的病原体之一[8]。
轮状病毒的治疗并不复杂,但每年仍有超过450,000名五岁以下的婴幼儿因为轮状病毒的感染而死亡[9],而且每年有几乎两百万以上的儿童因此患重病[7]。在美国实施疫苗施打计画之前,轮状病毒每年造成270万个儿童严重肠胃炎的案例,有近60,000名儿童需住院治疗,并且每年平均有37个死亡案例[10]。对付轮状病毒的方式著重于使用口服补液盐,并且以疫苗接种来防止这种疾病的发生[11]。在疫苗施打实施之后,轮状病毒的病例即大幅减少[12][13]。
症状及征象
[编辑]轮状病毒肠胃炎是一种中等或重度的急性疾病,会引起恶心、呕吐、水状腹泻,以及低程度的发热。当儿童受到这类病毒感染时,在症状发生前大约会有两天的潜伏期[14]。症状通常是从呕吐开始,接著是四到八天的大量腹泻。轮状病毒感染比起其他细菌性肠胃炎更容易引起脱水的现象,也是轮状病毒感染的最常见的死因[15]。
每个人终其一生都可能受到A种轮状病毒的感染。初次感染通常会产生症状,再次感染则通常只产生轻微症状或没有症状[4][16],因为免疫系统提供了部分的保护机制[2][17]。所以,感染症状发生的比例于两岁以下的儿童最高,之后渐渐降低直到45岁为止[18][19][20]。虽然新生儿感染的机会很常见,但是通常都是温和的症状或是无症状疾病[21][22];最严重的症状都会发生在比较大一点的出生六个月到两岁的小孩,以及发生在有免疫缺陷的小孩身上。大部分的成人因童年时期获得的免疫力,因此对于轮状病毒感染影响不大;成人发生的肠胃炎通常是因为其他病因而非轮状病毒,但是成人的无症状感染依然在社群中带有感染症的传染性[23]。有症状的再感染通常因为感染了不同血清型的轮状病毒A种[3][24]。
传染途径
[编辑]
轮状病毒是由粪口路径(fecal-oral route)所传染的,借由与接触弄脏的手、弄脏的表面以及弄脏的物体来传染[25],而且有可能经由呼吸路径传染[1]。受感染病患的粪便每克可以包含超过10兆[26]个有传染性的病毒颗粒[4];而其中只要10颗到100颗就可以借由传播而感染另一个人[27]。
轮状病毒在自然环境中是稳定的,也可以在河口的样本中发现,其样本大概每美制加仑可以发现1至5颗有传染性的轮状病毒颗粒[28]。消灭细菌与寄生虫的卫生设备似乎对于轮状病毒的控制是无效的,因为在高卫生水平与低卫生水平的国家中,轮状病毒感染的发病率是相似的[1]。
致病机转
[编辑]
腹泻是肇因于轮状病毒的多重活动。轮状病毒主要复制于消化道[29],并感染肠绒毛的肠细胞,造成上皮组织结构和功能上的改变[30],遭到该病毒的破坏而导致吸收不良。产生肠毒素的病毒蛋白质NSP4制造了倚赖钙离子的氯化分泌物,破坏了钠-葡萄糖协同运输蛋白1(sodium-glucose transport 1,SGLT1)载体[31]居中调节的水份再吸收,这个显然降低了刷状缘(brush border)薄膜双糖酵素(disaccharidase)的活动,而且可能激化肠神经系统中依赖钙离子的分泌(secretion)的反射作用[32][33]。健康的肠黏膜细胞会分泌乳糖酶进入小肠;所以因乳糖酶缺乏而造成的乳糖不耐症也是轮状病毒感染经常出现的症状[34][35],这个症状可以持续数周[36]。乳糖不耐症的再次发生通常与牛奶再次引入儿童的日常饮食有关,因为细菌发酵了在肚子内的双糖乳糖[37]。
诊断与检测
[编辑]轮状病毒感染的诊断一般都伴随著有严重的腹泻症状的肠胃炎。大部分的因为肠胃炎进入医院的儿童病患都被检测出轮状病毒A种[38][39]。对于轮状病毒A种传染病的专门诊断方式是对病患的粪便利用酵素免疫分析法去作病毒的识别。目前市场上已经有几种核准的监测设备,这些监测设备对于轮状病毒A种的所有血清型都可以敏感,个别的检测出来[40][41]。其他的检验方法,如电子显微镜法或是凝胶电泳法,则是使用在研究实验室之中[42]。逆转录聚合酶链锁反应(RT-PCR)可以检测并识别所有种与所有血清型的人类轮状病毒[43]。
治疗与预后
[编辑]剧烈的轮状病毒感染症的治疗方法并不特别,这包括了症状的控制与最重要的补充水分(Rehydration)[11]。如果没有治疗,儿童可能会因为严重脱水而死亡[44]。依据腹泻的严重度,治疗包含使用口服补液盐作为口服补液疗法。[45]。有一些感染症状较为严重,足以住院治疗,住院治疗时这些液体则是经由静脉滴入或是经由鼻胃管(nasogastric tube)进入病童身体,而病童的电解质与血糖必须要特别注意[38]。
轮状病毒感染很少造成其他的并发症,而且对于症状控制良好的儿童来说,预后是极佳的[46][47]。极少数的报告有出现在中枢神经系统(CNS)的并发症案例,在中枢神经系统中的液体中发现了轮状病毒,并且引起了脑炎与脑膜炎[48][49][50],而近期的研究结果也确认了轮状病毒并不会永远只限制在内脏里,还可能会引起病毒血症(viremia)[51]。
流行病学
[编辑]
在全世界各地流行的轮状病毒A种据统计是人类轮状病毒肠胃炎案例中超过90%以上的病媒[52],每年轮状病毒在发展中国家造成上亿的腹泻案例,有接近200万的病患住院治疗[7],而且据估计有611,000的死亡案例[53]。单独就美国而言,平均每年就发生超过270万件轮状病毒肠胃炎的案例,约60,000的病童必须住院治疗,而且有37名病童因为这个病毒感染症而死亡[10]。而轮状病毒是引起腹泻的主要角色并没有受到广泛的被公共卫生社群所承认,特别是发展中国家[7]。几乎每个儿童在五岁以前都曾感染过轮状病毒[53]。它是婴儿与幼儿严重腹泻的主要单一原因,其中大约20%的婴幼儿腹泻案例是归因于此,而统计大约50%的案例需要住院治疗[7]。男孩住院治疗的案例为女孩住院治疗的两倍[6][54]。
| 国家 | 死亡率或其范围 | 资料年份 | 资料来源 |
|---|---|---|---|
| 越南 | 1/61 至 1/113 | 2006 | [55] |
| 孟加拉 | 1/390 至 1/660 | 2007 | [56] |
| 委内瑞拉 | 1/1800 | 2007 | [57] |
| 欧盟 | 1/20433 | 2006 | [58] |
| 美国 | 1/21675 | 2007 | [10] |
在温带地区,轮状病毒感染症主要发生于冬季,但是在热带地区则是一年全年都会发生[59];其中的不同之处有部分可以用温带地区温度与湿度季节性的变化来解释[60][61]。对于可归因食物污染的数据尚未清楚[62]。
轮状病毒A种腹泻经常在医院的婴儿、参加托儿所的幼儿,以及在照养中心的老人之间爆发。1981年在美国科罗拉多州发生一次因为市区饮用水遭到污染而爆发大规模轮状病毒感染[63]。而在2005年期间,纪录上最大的腹泻大规模传染病疫情发生在尼加拉瓜。这次不寻常大且严重的疫情爆发是伴随著轮状病毒A种基因突变,也许这帮助了病毒逃离了民众体内普遍免疫力的保护[64]。另外一次类似的流行性大爆发则是发生在1977年的巴西[65]。
轮状病毒B种,也称为成人腹泻轮状病毒(adult diarrhoea rotavirus,ADRV),造成影响上千名中国各年龄层人民的严重腹泻大规模传染病。这些已经发生的传染病都是因为污水污染了饮用水的结果[66][67]。轮状病毒B种感染也发生在1998年的印度;这次成因的病毒株被命名为CAL,不像ADRV,CAL病毒株是地方性的[68][69]。目前为止,因为轮状病毒B种引起的流行病已经被限制在中国大陆,但是研究指出美国普遍缺乏对于该种病毒的免疫力[70]。
轮状病毒C种出现在许多国家中的小孩腹泻的极少数偶发案例中,但是在日本与英格兰曾经爆发过大规模流行[71][72]。
预防方法
[编辑]于2006年,两种对抗轮状病毒A种感染的疫苗已经证明对儿童是安全而且有效的:分别是由葛兰素史克制造的“罗特律”(Rotarix)[73]与由默克大药厂制造的“轮达停”(RotaTeq)[74]。两种疫苗皆是用口服接种,并且都包含了无作用力的活病毒。轮状病毒疫苗目前在澳洲[75]、欧洲、加拿大[76]、巴西[77]、埃及、印度、以色列、台湾、南非[78]、巴拿马、阿根廷与美国[79]等地都可以取得。
轮状病毒疫苗计画(Rotavirus Vaccine Program)是一个适宜卫生科技组织(Program for Appropriate Technology in Health,简写为 PATH)、世界卫生组织与美国疾病控制与预防中心的合作计画,该计画由全球疫苗与免疫联盟(GAVI Alliance)资助。该计画的目的是借由制造可以让发展中国家使用的轮状病毒疫苗,来降低儿童因为痢疾而产生的疾病与儿童死亡率[80]。
动物的感染
[编辑]轮状病毒也会感染年幼的动物并造成腹泻。各项研究显示,轮状病毒会感染哺乳动物(如:猿猴[81]、牛[82]、猪[83]、羊[8]、田鼠[84]、猫与狗[85]、家鼠[86]、马[87]与兔子[88]等)以及鸟类(鸡与火鸡等)[89]等。这些感染动物的轮状病毒是有与感染人类的轮状病毒产生基因交换的潜在可能性。目前已经证明感染动物的轮状病毒也可以感染人类,感染途径包括病毒的直接传染以及提供感染人类的病毒株一段或是数段的核糖核酸片段来进行基因重整(reassortment)[90][91]。轮状病毒是家畜的病原体之一,并且治疗的费用、家畜的高罹病率与高死亡率都会造成农人的经济损失[8]。
病毒学
[编辑]轮状病毒的种类
[编辑]轮状病毒总共有七种,分别以英文字母编号为A、B、C、D、E、F与G等。人类主要是受到轮状病毒A种、B种与C种的感染,而其中最常见的是轮状病毒A种的感染。而这七种轮状病毒都会在其他动物身上造成疾病[92]。
在轮状病毒A种之中有不同的病毒株,称之为血清变异株(serovar)[93]。与流行性感冒病毒类似,轮状病毒使用了双重的分类系统,这样分类法是依据这个病毒体表面的两个结构性蛋白质来作分类的。糖蛋白VP7定义了G型而对于蛋白酶敏感的蛋白质VP4则定义了P型(这些蛋白质的细节请见下文)。P型会以一个数字来标示出P血清型,并用方括弧内部的一个数字来标示所对应的P基因型。G血清型的表示方法很类似,但是G基因型的数字会与G血清型的数字相同。举个例来说,“轮状病毒Wa病毒株”(rotavirus strain Wa)就会被标示成“P1A[8]G1”[94]。因为这两个决定G型跟P型的基因可以被分开传送而产生后代,所以两基因不同的组合就会产生各种不同的病毒株[95]。
结构
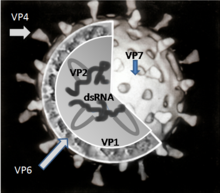
[编辑]轮状病毒的基因组包括了11条独特的核糖核酸双螺旋分子,这11条中总共有18,555个核苷碱基对。每一条螺旋或是分段即是一个基因,并且依照分子尺寸由大到小依次编号为1到11。每一个基因都可以编码成一种蛋白质,而其中第9基因与第11基因比较特别,它们都可以编码成两种蛋白质[96]。核糖核酸外围则是包围了三层二十面体的蛋白质壳体。病毒颗粒大约直径76.5 nm[97][98],并且并没有病毒包膜(Viral envelope)。
蛋白质
[编辑]有六个病毒蛋白质(viral protein,VP)架构了整个病毒颗粒(病毒体)。这些“结构性”的蛋白质分别被称为VP1、VP2、VP3、VP4、VP6与VP7。除了这些结构性蛋白质之外,还有六个非结构性蛋白质(nonstructural protein,NSP),这六个蛋白质仅仅在轮状病毒感染的细胞中制造,而没有构成病毒体的结构。这六个非结构性蛋白质分别称为NSP1、NSP2、NSP3、NSP4、NSP5与NSP6。
由轮状病毒基因组所编码的12个蛋白质中,至少6个会与核糖核酸结合[99]。这些蛋白质在轮状病毒复制时所扮演的角色目前还没有完全被了解;它们的功用被认为有可能是与病毒体内核糖核酸的合成与包装相关,或是与将信使核糖核酸输送至基因体复制现场相关,或是与信使核糖核酸转译与基因表现调节相关[100]。
结构性蛋白
[编辑]VP1蛋白质位于病毒体核心,是一种核糖核酸聚合酶[101]。在被感染的细胞中,这种酶会产生病毒蛋白质合成所需的信使核糖核酸转录复本,以及产生轮状病毒基因体核糖核酸片段拷贝来提供新产生的病毒体使用。

VP2蛋白质形成病毒体的核心层,并且结合核糖核酸基因体[102]。
VP3蛋白质是病毒体内核的一部分,而且是一种称为鸟苷酸转移酶(guanylyl transferase)的酶。这种酶是一种加帽酶(Capping enzyme),也就是制作信使核糖核酸转录后修饰时候所用的5'端帽的酶[103]。这个5'端帽保护病毒的信使核糖核酸免受核酸酶(以核酸为底物的水解酶)水解,使之能够保持稳定。

VP4蛋白质位于病毒体的表面,突出来而成为一个刺突(spike)[104]。它连接细胞表面的受体分子,并且驱使病毒进入那个细胞[105]。在病毒有传染性之前,VP4蛋白质会被一种可以在内脏发现的蛋白酶改变成VP5*蛋白质与VP8*蛋白质[106]。VP4蛋白质决定了该病毒的毒性(Virulence),而它也决定了该病毒的P型[107]。

VP6蛋白质形成壳体的体积。它是抗原性强的蛋白质,并且可以被用来分辨轮状病毒的种类[4]。这个蛋白质被实验室用来进行轮状病毒A种感染症的各种测试上[41]。
VP7蛋白质是一种建立病毒体外层表面的糖蛋白。扣除掉它在病毒结构上的功用之外,它也决定该病毒珠的G型。VP7蛋白质跟VP4蛋白质一样,都被免疫力(immunity)当作是防止感染的途径[97]。
病毒的非结构性蛋白
[编辑]NSP1蛋白质是第5号基因的产物,是一种非结构性蛋白质,而且也是核糖核酸结合蛋白质(RNA-binding protein)[108]。
NSP2蛋白质是一种核糖核酸结合蛋白质,此种蛋白质会堆积于细胞质内含物(即病毒质,viroplasm)之中,并且是一种基因体复制时所需的蛋白质[109][110]。
NSP3蛋白质受到感染细胞中的病毒信使核糖核酸影响,它负责停止细胞蛋白质合成的工作[111]。
NSP4蛋白质是一种病毒性肠毒素(enterotoxin),会引起腹泻的症状。此蛋白质是首种发现的病毒性肠毒素[112]。
NSP5蛋白质是由轮状病毒A种基因体第11号基因编码的产物。而在受病毒感染的细胞中,NSP5蛋白质堆积在病毒质中[113]。
NSP6蛋白质是一个结合核酸的蛋白质[114],是由第11号基因于开放阅读框架阶段的编码产物[115]。
| 核糖核酸片段 (基因) |
尺寸 (碱基对数) |
蛋白质 | 分子量 (kDa) |
所在位置 | 功用 |
|---|---|---|---|---|---|
| 1 | 3302 | VP1 | 125 | 位于核心的顶点 | 核糖核酸依赖性的核糖核酸聚合酶(RdRp) |
| 2 | 2690 | VP2 | 102 | 形成核心的内壳 | 刺激病毒的核糖核酸复制酶 |
| 3 | 2591 | VP3 | 88 | 位于核心的顶点 | 鸟苷酸转移酶,信使核糖核酸加帽酶 |
| 4 | 2362 | VP4 | 87 | 表面刺突 | 细胞附著,毒性 |
| 5 | 1611 | NSP1 | 59 | 非结构性 | 对于病毒成长非必须 |
| 6 | 1356 | VP6 | 45 | 内壳体 | 结构性与物种特殊性的抗原 |
| 7 | 1104 | NSP3 | 37 | 非结构性 | 强化病毒信使核糖核酸的活性,并停止受感染细胞的蛋白质合成 |
| 8 | 1059 | NSP2 | 35 | 非结构性 | 包含在核糖核酸包装中的核苷三磷酸酶(NTPase) |
| 9 | 1062 | VP71 VP72 |
38 34 |
表面 | 结构性与中和抗原 |
| 10 | 751 | NSP4 | 20 | 非结构性 | 肠毒素 |
| 11 | 667 | NSP5 NSP6 |
22 | 非结构性 | 结合NSP2调节因子的单链核糖核酸与双链核糖核酸 |
该表的资料是基于感染类人猿的轮状病毒SA11病毒株所编写[116][117]。在不同的病毒株中,核糖核酸与蛋白质之间的编码预测会有所不同。
复制
[编辑]
轮状病毒感染小肠绒毛(villi)的肠黏膜细胞,改变上皮组织的结构与功能[30]。轮状病毒的三重蛋白质外层使它们可以抵抗胃中的胃酸以及消化系统中的消化酶(digestive enzyme)。
病毒借由受体媒介的内吞作用进入细胞,并且形成一个称作核内体(endosome)的囊泡。轮状病毒第三层的蛋白质(即VP7与VP4刺突)会分解核内体的外膜,而创造一个钙浓度不同的外膜。这个改变导致了VP7蛋白质三聚体破裂为一个单一蛋白质的子单元,留下围绕在病毒双链核糖核酸外面的VP2与VP6蛋白质,形成双层构造的病毒颗粒(DLP)。
七条双链核糖核酸链依旧维持两层蛋白质层,并提供病毒核糖核酸依赖性的核糖核酸聚合酶(RNA replicase或RNA-dependent RNA polymerase,RdRp)创造双链病毒基因体的信使核糖核酸转录复本的保护。借由把病毒核糖核酸保持于病毒核心,病毒核糖核酸躲避了先天宿主的免疫反应。这个免疫反应称为核糖核酸干扰,会因为双链核糖核酸链的表现而触发。
在感染的过程中,轮状病毒产生信使核糖核酸来生物合成蛋白质并且进行基因复制。大部分的轮状病毒蛋白质都堆积在病毒质中,病毒质也是核糖核酸复制的地方,以及双层构造病毒颗粒组装的地方。病毒质于病毒感染细胞约两个小时之内就会快速地在细胞核周围形成,而组成所谓的“病毒工厂”,这个病毒工厂是由两个病毒非结构性蛋白质(NSP5与NSP2)所制成。NSP5蛋白质如果因为核糖核酸干扰而被压抑功能,会明显地减弱轮状病毒复制功能。新生的双层构造病毒颗粒则会移动到内质网,它们将在此处获得它们第三层外层(由VP7与VP4蛋白质所构成)。最后,这些后代病毒就会经由细胞裂解(lysis)释放到细胞之外[118][119]。
发现历史
[编辑]
1943年,雅各·莱特(Jacob Light)与荷瑞西·赫德斯(Horace Hodes)证明了在感染传染性腹泻的小孩身上有一种滤过性的病媒,这个病媒也会造成家畜腹泻[120]。30年后,被保存下来的病媒样本证明此病媒是轮状病毒[121]。从1943年到1973年间,研究发现老鼠[122]身上的病毒与引起成腹泻的病毒间有相关性[123]。1973年,位于澳洲的露丝·毕夏普(Ruth Bishop)在儿童肠胃炎的研究报告上描述出类似的病毒[5][124]。
1974年,汤玛斯·亨利·费留特(Thomas Henry Flewett)在通过电子显微镜观察过这类病毒之后,建议将其命名为“轮状病毒”(rotavirus),因为轮状病毒的颗粒看起来很像轮子,而拉丁文中“rota”的意思即为“轮状”[125][126];这个名称四年后经由国际病毒分类委员会(International Committee on Taxonomy of Viruses)正式认可[127]。1976年,相关类似的病毒也在许多其他种动物的研究上被描述到[123]。这些被报告描述的病毒,通通都会导致急性肠胃炎,并且被认定为影响全世界人类与动物的集体病原体[125]。轮状病毒的血清型于1980年首次发表[128],而在隔年,来自人体的轮状病毒借由添加胰蛋白酶(一种发现于哺乳动物十二指肠的酶,目前已知是轮状病毒复制所必须的物质)首次在从自然环境中猴子肾脏取得的细胞培养中成功栽培[129]。成功培养轮状病毒的能力加速了研究的脚步,且在1980年代中期,首批候选的疫苗已经开始进行评估[130]。
1998年,首种轮状病毒疫苗(Rotavirus vaccine)[131]获得在美国使用的执照。在美国、芬兰与委内瑞拉的临床试验发现该疫苗可以对于成功预防轮状病毒A种所产生的严重腹泻比率高达80%至100%,而研究者也没有发现显著的严重药物不良反应[132][133]。然而,在该疫苗被发现会增加肠套叠(即肠梗阻(bowel obstruction)的一种)的风险之后,疫苗制造商在1999年将疫苗从市场上全部撤回,研究显示每12,000注射过疫苗的婴儿有一个会有肠套叠的症状[134]。这次经验也引发了关于轮状病毒疫苗的相关风险与益处的激烈争论[135]。2006年,两种对抗轮状病毒A种的新疫苗被证明对儿童是安全而且是有效预防的[136]。
参见
[编辑]- 肠胃炎
- 婴儿死亡(infant mortality)
- 轮状病毒转译(rotavirus translation)
- 轮状病毒顺式复制元件(rotavirus cis-acting replication element,rotavirus CRE)
注释与参考文献
[编辑]- ^ 1.0 1.1 1.2 Dennehy PH. Transmission of rotavirus and other enteric pathogens in the home. Pediatr. Infect. Dis. J. 2000, 19 (10 Suppl): S103–5. PMID 11052397. doi:10.1097/00006454-200010001-00003.
- ^ 2.0 2.1 Velázquez FR, Matson DO, Calva JJ, Guerrero L, Morrow AL, Carter-Campbell S, Glass RI, Estes MK, Pickering LK, Ruiz-Palacios GM. Rotavirus infections in infants as protection against subsequent infections. N. Engl. J. Med. 1996, 335 (14): 1022–8 [2008-12-19]. PMID 8793926. doi:10.1056/NEJM199610033351404. (原始内容存档于2009-05-18).
- ^ 3.0 3.1 Linhares AC, Gabbay YB, Mascarenhas JD, Freitas RB, Flewett TH, Beards GM. Epidemiology of rotavirus subgroups and serotypes in Belem, Brazil: a three-year study. Ann. Inst. Pasteur Virol. 1988, 139 (1): 89–99. PMID 2849961. doi:10.1016/S0769-2617(88)80009-1.
- ^ 4.0 4.1 4.2 4.3 Bishop RF. Natural history of human rotavirus infection. Arch. Virol. Suppl. 1996, 12: 119–28. PMID 9015109.
- ^ 5.0 5.1 Bishop RF, Davidson GP, Holmes IH, Ruck BJ. Virus particles in epithelial cells of duodenal mucosa from children with acute non-bacterial gastroenteritis. Lancet. 1973, 2 (7841): 1281–3. PMID 4127639. doi:10.1016/S0140-6736(73)92867-5.
- ^ 6.0 6.1 Rheingans RD, Heylen J, Giaquinto C. Economics of rotavirus gastroenteritis and vaccination in Europe: what makes sense?. Pediatr. Infect. Dis. J. 2006, 25 (1 Suppl): S48–55. PMID 16397429. doi:10.1097/01.inf.0000197566.47750.3d.
- ^ 7.0 7.1 7.2 7.3 7.4 Simpson E, Wittet S, Bonilla J, Gamazina K, Cooley L, Winkler JL. Use of formative research in developing a knowledge translation approach to rotavirus vaccine introduction in developing countries. BMC Public Health. 2007, 7: 281 [2008-12-19]. PMID 17919334. doi:10.1186/1471-2458-7-281. (原始内容存档于2015-09-24).
- ^ 8.0 8.1 8.2 Holland RE. Some infectious causes of diarrhea in young farm animals. Clin. Microbiol. Rev. 1990, 3 (4): 345–75 [2008-12-19]. PMID 2224836. (原始内容 (PDF)存档于2011-09-28).
- ^ Tate JE, Burton AH, Boschi-Pinto C, Steele AD, Duque J, Parashar UD. 2008 estimate of worldwide rotavirus-associated mortality in children younger than 5 years before the introduction of universal rotavirus vaccination programmes: a systematic review and meta-analysis. Lancet Infect Dis. February 2012, 12 (2): 136–141. PMID 22030330. doi:10.1016/S1473-3099(11)70253-5.
- ^ 10.0 10.1 10.2 Fischer TK, Viboud C, Parashar U; et al. Hospitalizations and deaths from diarrhea and rotavirus among children <5 years of age in the United States, 1993–2003. J. Infect. Dis. 2007, 195 (8): 1117–25. PMID 17357047. doi:10.1086/512863.
- ^ 11.0 11.1 Diggle L. Rotavirus diarrhoea and future prospects for prevention. Br. J. Nurs. 2007, 16 (16): 970–4. PMID 18026034.
- ^ Giaquinto C, Dominiak-Felden G, Van Damme P, Myint TT, Maldonado YA, Spoulou V, Mast TC, Staat MA. Summary of effectiveness and impact of rotavirus vaccination with the oral pentavalent rotavirus vaccine: a systematic review of the experience in industrialized countries. Human Vaccines. July 2011, 7 (7): 734–48 [2016-04-17]. PMID 21734466. doi:10.4161/hv.7.7.15511. (原始内容存档于2020-05-04).
- ^ Jiang V, Jiang B, Tate J, Parashar UD, Patel MM. Performance of rotavirus vaccines in developed and developing countries. Human Vaccines. July 2010, 6 (7): 532–42 [2016-04-17]. PMC 3322519
 . PMID 20622508. doi:10.4161/hv.6.7.11278. (原始内容存档于2020-06-04).
. PMID 20622508. doi:10.4161/hv.6.7.11278. (原始内容存档于2020-06-04).
- ^ Hochwald C, Kivela L. Rotavirus vaccine, live, oral, tetravalent (RotaShield). Pediatr. Nurs. 1999, 25 (2): 203–4, 207. PMID 10532018.
- ^ Maldonado YA, Yolken RH. Rotavirus. Baillieres Clin. Gastroenterol. 1990, 4 (3): 609–25. PMID 1962726. doi:10.1016/0950-3528(90)90052-I.
- ^ Glass RI, Parashar UD, Bresee JS, Turcios R, Fischer TK, Widdowson MA, Jiang B, Gentsch JR. Rotavirus vaccines: current prospects and future challenges. Lancet. July 2006, 368 (9532): 323–32. PMID 16860702. doi:10.1016/S0140-6736(06)68815-6.
- ^ Offit PA. Gastroenteritis viruses. New York: Wiley. 2001: 106–124. ISBN 0-471-49663-4.
- ^ Ramsay M and Brown D. Desselberger, U.; Gray, James , 编. Rotaviruses: methods and protocols. Totowa, NJ: Humana Press. 2000: 217. ISBN 0-89603-736-3.Free ebook [1] (页面存档备份,存于互联网档案馆)
- ^ Bernstein DI, Sander DS, Smith VE, Schiff GM, Ward RL. Protection from rotavirus reinfection: 2-year prospective study. J. Infect. Dis. 1991, 164 (2): 277–83. PMID 1649875.
- ^ Koopman JS, Monto AS. The Tecumseh Study. XV: Rotavirus infection and pathogenicity. Am. J. Epidemiol. 1989, 130 (4): 750–9. PMID 2549788.
- ^ Cameron DJ, Bishop RF, Veenstra AA, Barnes GL. Noncultivable viruses and neonatal diarrhea: Fifteen-month survey in a newborn special care nursery. J. Clin. Microbiol. 1978, 8 (1): 93–8 [2008-12-20]. PMID 209058. (原始内容 (PDF)存档于2011-09-27).
- ^ Grillner L, Broberger U, Chrystie I, Ransjö U. Rotavirus infections in newborns: an epidemiological and clinical study. Scand. J. Infect. Dis. 1985, 17 (4): 349–55. PMID 3003889.
- ^ Hrdy DB. Epidemiology of rotaviral infection in adults. Rev. Infect. Dis. 1987, 9 (3): 461–9. PMID 3037675.
- ^ De Champs C, Laveran H, Peigue-Lafeuille H; et al. Sequential rotavirus infections: characterization of serotypes and electrophoretypes. Res. Virol. 1991, 142 (1): 39–45. PMID 1647052. doi:10.1016/0923-2516(91)90026-Y.
- ^ Butz AM, Fosarelli P, Dick J, Cusack T, Yolken R. Prevalence of rotavirus on high-risk fomites in day-care facilities. Pediatrics. 1993, 92 (2): 202–5. PMID 8393172.
- ^ 即1013
- ^ Graham DY, Dufour GR, Estes MK. Minimal infective dose of rotavirus. Arch. Virol. 1987, 92 (3–4): 261–71. PMID 3028333. doi:10.1007/BF01317483.
- ^ Rao VC, Seidel KM, Goyal SM, Metcalf TG, Melnick JL. Isolation of enteroviruses from water, suspended solids, and sediments from Galveston Bay: survival of poliovirus and rotavirus adsorbed to sediments. Appl. Environ. Microbiol. 1984, 48 (2): 404–9 [2008-12-21]. PMID 6091548. (原始内容 (PDF)存档于2011-09-27).
- ^ Greenberg HB, Estes MK. Rotaviruses: from pathogenesis to vaccination. Gastroenterology. 2009, 136 (6): 1939–51. PMC 3690811
 . PMID 19457420. doi:10.1053/j.gastro.2009.02.076.
. PMID 19457420. doi:10.1053/j.gastro.2009.02.076.
- ^ 30.0 30.1 Greenberg HB, Clark HF, Offit PA. Rotavirus pathology and pathophysiology. Ramig RF (编). Rotaviruses. Current Topics in Microbiology and Immunology 185. New York: Springer. 1994: 255–83. ISBN 9783540567615. PMID 8050281. doi:10.1007/978-3-642-78256-5_9.
- ^ 即膜运输蛋白(membrane transport protein)
- ^ Ball JM, Mitchell DM, Gibbons TF, Parr RD. Rotavirus NSP4: a multifunctional viral enterotoxin. Viral Immunol. 2005, 18 (1): 27–40. PMID 15802952. doi:10.1089/vim.2005.18.27.
- ^ Lorrot M, Vasseur M. How do the rotavirus NSP4 and bacterial enterotoxins lead differently to diarrhea?. Virol. J. 2007, 4: 31 [2008-12-21]. PMID 17376232. doi:10.1186/1743-422X-4-31. (原始内容存档于2011-09-28).
- ^ Jourdan N, Brunet JP, Sapin C; et al. Rotavirus infection reduces sucrase-isomaltase expression in human intestinal epithelial cells by perturbing protein targeting and organization of microvillar cytoskeleton. J. Virol. 1998, 72 (9): 7228–36 [2008-12-21]. PMID 9696817. (原始内容存档于2011-09-28).
- ^ Davidson GP, Barnes GL. Structural and functional abnormalities of the small intestine in infants and young children with rotavirus enteritis. Acta. Paediatr. Scand. 1979, 68 (2): 181–6. PMID 217231. doi:10.1111/j.1651-2227.1979.tb04986.x.
- ^ Ouwehand A, Vesterlund S. Health aspects of probiotics. IDrugs. 2003, 6 (6): 573–80. PMID 12811680.
- ^ Arya SC. Rotaviral infection and intestinal lactase level. J. Infect. Dis. 1984, 150 (5): 791. PMID 6436397.
- ^ 38.0 38.1 Patel MM, Tate JE, Selvarangan R; et al. Routine laboratory testing data for surveillance of rotavirus hospitalizations to evaluate the impact of vaccination. Pediatr. Infect. Dis. J. 2007, 26 (10): 914–9. PMID 17901797.
- ^ The Pediatric ROTavirus European CommitTee (PROTECT). The paediatric burden of rotavirus disease in Europe. Epidemiol. Infect. 2006, 134 (5): 908–16. PMID 16650331. doi:10.1017/S0950268806006091.
- ^ Smith TF, Wold AD, Espy MJ, Marshall WF. New developments in the diagnosis of viral diseases. Infect. Dis. Clin. North Am. 1993, 7 (2): 183–201. PMID 8345165.
- ^ 41.0 41.1 Beards GM, Campbell AD, Cottrell NR, Peiris JS, Rees N, Sanders RC, Shirley JA, Wood HC, Flewett TH. Enzyme-linked immunosorbent assays based on polyclonal and monoclonal antibodies for rotavirus detection. J. Clin. Microbiol. 1984, 19 (2): 248–54 [2008-12-21]. PMID 6321549. (原始内容 (PDF)存档于2011-09-27).
- ^ Beards GM. Laboratory diagnosis of viral gastroenteritis. Eur. J. Clin. Microbiol. Infect. Dis. 1988, 7 (1): 11–3. PMID 3132369. doi:10.1007/BF01962164.
- ^ Fischer TK, Gentsch JR. Rotavirus typing methods and algorithms. Rev. Med. Virol. 2004, 14 (2): 71–82. PMID 15027000. doi:10.1002/rmv.411.
- ^ Alam NH, Ashraf H. Treatment of infectious diarrhea in children. Paediatr. Drugs. 2003, 5 (3): 151–65. PMID 12608880.
- ^ Sachdev HP. Oral rehydration therapy. Journal of the Indian Medical Association. 1996, 94 (8): 298–305. PMID 8855579.
- ^ Haffejee IE. The pathophysiology, clinical features and management of rotavirus diarrhoea. Q. J. Med. 1991, 79 (288): 289–299 [2008-12-21]. PMID 1649479. (原始内容存档于2008-12-18).
- ^ Ramig RF. Systemic rotavirus infection. Expert review of anti-infective therapy. 2007, 5 (4): 591–612. PMID 17678424. doi:10.1586/14787210.5.4.591.
- ^ Goto T, Kimura H, Numazaki K; et al. A case of meningoencephalitis associated with G1P[8] rotavirus infection in a Japanese child. Scand. J. Infect. Dis. 2007, 39 (11): 1067–70. PMID 17852929. doi:10.1080/00365540701466249.
- ^ Kehle J, Metzger-Boddien C, Tewald F, Wald M, Schüürmann J, Enders G. First case of confirmed rotavirus meningoencephalitis in Germany. Pediatr. Infect. Dis. J. 2003, 22 (5): 468–70. PMID 12797316. doi:10.1097/00006454-200305000-00020.
- ^ Pager C, Steele D, Gwamanda P, Driessen M. A neonatal death associated with rotavirus infection—detection of rotavirus dsRNA in the cerebrospinal fluid. S. Afr. Med. J. 2000, 90 (4): 364–5. PMID 10957919.
- ^ Widdowson MA, Bresee JS, Gentsch JR, Glass RI. Rotavirus disease and its prevention. Curr. Opin. Gastroenterol. 2005, 21 (1): 26–31 [2008-12-21]. PMID 15687881. (原始内容存档于2012-02-09).
- ^ Leung AK, Kellner JD, Davies HD. Rotavirus gastroenteritis. Adv. Ther. 2005, 22 (5): 476–87. PMID 16418157. doi:10.1007/BF02849868.
- ^ 53.0 53.1 Parashar UD, Gibson CJ, Bresse JS, Glass RI. Rotavirus and severe childhood diarrhea. Emerging Infect. Dis. 2006, 12 (2): 304–6. PMID 16494759.
- ^ Ryan MJ, Ramsay M, Brown D, Gay NJ, Farrington CP, Wall PG. Hospital admissions attributable to rotavirus infection in England and Wales. J. Infect. Dis. 1996,. 174 Suppl 1: S12–8. PMID 8752285.
- ^ Anh DD, Thiem VD, Fischer TK, Canh DG, Minh TT, Tho le H, Van Man N, Luan le T, Kilgore P, von Seidlein L, Glass RI. The burden of rotavirus diarrhea in Khanh Hoa Province, Vietnam: baseline assessment for a rotavirus vaccine trial. Pediatr. Infect. Dis. J. 2006, 25 (1): 37–40. PMID 16395100. doi:10.1097/01.inf.0000195635.05186.52.
- ^ Tanaka G, Faruque AS, Luby SP, Malek MA, Glass RI, Parashar UD. Deaths from rotavirus disease in Bangladeshi children: estimates from hospital-based surveillance. Pediatr. Infect. Dis. J. 2007, 26 (11): 1014–8. PMID 17984808.
- ^ Pérez-Schael I, Salinas B, González R, Salas H, Ludert JE, Escalona M, Alcalá A, Rosas MA, Materán M. Rotavirus mortality confirmed by etiologic identification in Venezuelan children with diarrhea. Pediatr. Infect. Dis. J. 2007, 26 (5): 393–7. PMID 17468648. doi:10.1097/01.inf.0000260252.48129.86.
- ^ Soriano-Gabarró M, Mrukowicz J, Vesikari T, Verstraeten T. Burden of rotavirus disease in European Union countries. Pediatr. Infect. Dis. J. 2006, 25 (1 Suppl): S7–S11. PMID 16397431. doi:10.1097/01.inf.0000197622.98559.01.
- ^ Cook SM, Glass RI, LeBaron CW, Ho MS. Global seasonality of rotavirus infections. Bull. World Health Organ. 1990, 68 (2): 171–7. PMID 1694734.
- ^ Moe K, Harper GJ. The effect of relative humidity and temperature on the survival of bovine rotavirus in aerosol. Arch. Virol. 1983, 76 (3): 211–6. PMID 6307226. doi:10.1007/BF01311105.
- ^ Moe K, Shirley JA. The effects of relative humidity and temperature on the survival of human rotavirus in faeces. Arch. Virol. 1982, 72 (3): 179–86. PMID 6287970. doi:10.1007/BF01348963.
- ^ Koopmans M, Brown D. Seasonality and diversity of Group A rotaviruses in Europe. Acta paediatrica (Oslo, Norway : 1992). Supplement. 1999, 88 (426): 14–9. PMID 10088906. doi:10.1111/j.1651-2227.1999.tb14320.x.
- ^ Hopkins RS, Gaspard GB, Williams FP, Karlin RJ, Cukor G, Blacklow NR. A community waterborne gastroenteritis outbreak: evidence for rotavirus as the agent. American Journal of Public Health. 1984, 74 (3): 263–5. PMID 6320684.[失效链接]
- ^ Bucardo F, Karlsson B, Nordgren J; et al. Mutated G4P[8] rotavirus associated with a nationwide outbreak of gastroenteritis in Nicaragua in 2005. J. Clin. Microbiol. 2007, 45 (3): 990–7 [2008-12-21]. PMID 17229854. doi:10.1128/JCM.01992-06. (原始内容存档于2011-09-27).
- ^ Linhares AC, Pinheiro FP, Freitas RB, Gabbay YB, Shirley JA, Beards GM. An outbreak of rotavirus diarrhea among a non-immune, isolated South American Indian community. Am. J. Epidemiol. 1981, 113 (6): 703–10. PMID 6263087.
- ^ Hung T, Chen GM, Wang CG; et al. Waterborne outbreak of rotavirus diarrhea in adults in China caused by a novel rotavirus. Lancet. 1984, 1 (8387): 1139–42. PMID 6144874.
- ^ Fang ZY, Ye Q, Ho MS; et al. Investigation of an outbreak of adult diarrhea rotavirus in China. J. Infect. Dis. 1989, 160 (6): 948–53. PMID 2555422.
- ^ Kelkar SD, Zade JK. Group B rotaviruses similar to strain CAL-1, have been circulating in Western India since 1993. Epidemiol. Infect. 2004, 132 (4): 745–9. PMID 15310177. doi:10.1017/S0950268804002171.
- ^ Ahmed MU, Kobayashi N, Wakuda M, Sanekata T, Taniguchi K, Kader A, Naik TN, Ishino M, Alam MM, Kojima K, Mise K, Sumi A. Genetic analysis of group B human rotaviruses detected in Bangladesh in 2000 and 2001. J. Med. Virol. 2004, 72 (1): 149–55. PMID 14635024. doi:10.1002/jmv.10546.
- ^ Penaranda ME, Ho MS, Fang ZY; et al. Seroepidemiology of adult diarrhea rotavirus in China, 1977 to 1987. J. Clin. Microbiol. 1989, 27 (10): 2180–3 [2008-12-21]. PMID 2479654. (原始内容 (PDF)存档于2011-09-27).
- ^ Kuzuya M, Fujii R, Hamano M, Nishijima M, Ogura H. Detection and molecular characterization of human group C rotaviruses in Okayama Prefecture, Japan, between 1986 and 2005. J. Med. Virol. 2007, 79 (8): 1219–28. PMID 17596825. doi:10.1002/jmv.20910.
- ^ Brown DW, Campbell L, Tomkins DS, Hambling MH. School outbreak of gastroenteritis due to atypical rotavirus. Lancet. 1989, 2 (8665): 737–8. PMID 2570978. doi:10.1016/S0140-6736(89)90794-0.
- ^ O'Ryan M. Rotarix (RIX4414): an oral human rotavirus vaccine. Expert review of vaccines. 2007, 6 (1): 11–9. PMID 17280473. doi:10.1586/14760584.6.1.11.
- ^ Matson DO. The pentavalent rotavirus vaccine, RotaTeq. Seminars in paediatric infectious diseases. 2006, 17 (4): 195–9. PMID 17055370. doi:10.1053/j.spid.2006.08.005.
- ^ Rotarix vaccine launched in Australia (新闻稿). GlaxoSmithKline. 2006-05-14 [2008-08-18]. (原始内容存档于2013-04-29).
- ^ RotaTeq Is Approved In Canada (PDF) (新闻稿). Merck Frosst Canada. 2006-08-23 [2008-08-18]. (原始内容 (PDF)存档于2008-10-02).
- ^ Gurgel RQ, Cunliffe NA, Nakagomi O, Cuevas LE. Rotavirus genotypes circulating in Brazil before national rotavirus vaccination: a review. J. Clin. Virol. September 2008, 43 (1): 1–8 [2008-12-04]. PMID 18567534. doi:10.1016/j.jcv.2008.04.010. (原始内容存档于2021-02-12).
- ^ The Introduction of Rotavirus Vaccines in South Africa. National Center for Communicable Disease, Johannesburg, South Africa. 2006 [2008-12-21]. (原始内容存档于2016-08-06).
- ^ Tom-Revzon C. Rotavirus live, oral, pentavalent vaccine. Clin. Ther. 2007, 29 (12): 2724–37. PMID 18201590. doi:10.1016/j.clinthera.2007.12.018.
- ^ Accelerating access to rotavirus vaccines PATH, access date July 22 2008. [2008-12-21]. (原始内容存档于2009-05-06).
- ^ Ashley CR, Caul EO, Clarke SK, Corner BD, Dunn S. Rotavirus infections of apes. Lancet. 1978, 2 (8087): 477. PMID 79844. doi:10.1016/S0140-6736(78)91485-X.
- ^ Wani SA, Bhat MA, Ishaq SM, Ashrafi MA. Determination of bovine rotavirus G genotypes in Kashmir, India. Rev. - Off. Int. Epizoot. 2004, 23 (3): 931–6. PMID 15861888.
- ^ Saif LJ. Enteric viral infections of pigs and strategies for induction of mucosal immunity. Advances in veterinary medicine. 1999, 41: 429–46. PMID 9890034. doi:10.1016/S0065-3519(99)80033-0.
- ^ Pérez-Cano FJ, Castell M, Castellote C, Franch A. Characterization of Clinical and Immune Response in a Rotavirus Diarrhea Model in Suckling Lewis Rats. Pediatr Res. 2007. PMID 17957154.
- ^ Enriquez C, Nwachuku N, Gerba CP. Direct exposure to animal enteric pathogens. Reviews on environmental health. 2001, 16 (2): 117–31. PMID 11512628.
- ^ Feng N, Franco MA, Greenberg HB. Murine model of rotavirus infection. Adv. Exp. Med. Biol. 1997, 412: 233–40. PMID 9192019.
- ^ Hardy ME, Woode GN, Xu ZC; et al. Analysis of serotypes and electropherotypes of equine rotaviruses isolated in the United States. J. Clin. Microbiol. May 1991, 29 (5): 889–93 [2008-12-22]. PMC 269902
 . PMID 1647407. (原始内容存档于2011-05-25).
. PMID 1647407. (原始内容存档于2011-05-25).
- ^ Thouless ME, DiGiacomo RF, Deeb BJ, Howard H. Pathogenicity of rotavirus in rabbits. J. Clin. Microbiol. 1988, 26 (5): 943–7 [2008-12-22]. PMID 2838507. (原始内容 (PDF)存档于2011-09-27).
- ^ Guy JS. Virus infections of the gastrointestinal tract of poultry. Poult. Sci. 1998, 77 (8): 1166–75. PMID 9706084. (原始内容 (PDF)存档于2008-12-25).
- ^ Müller H, Johne R. Rotaviruses: diversity and zoonotic potential—a brief review. Berl. Munch. Tierarztl. Wochenschr. 2007, 120 (3–4): 108–12. PMID 17416132.
- ^ Cook N, Bridger J, Kendall K, Gomara MI, El-Attar L, Gray J. The zoonotic potential of rotavirus. J. Infect. 2004, 48 (4): 289–302. PMID 15066329. doi:10.1016/j.jinf.2004.01.018.
- ^ Beards GM, Brown DW. The antigenic diversity of rotaviruses: Significance to epidemiology and vaccine strategies. Eur. J. Epidemiol. 1988, 4 (1): 1–11. PMID 2833405. doi:10.1007/BF00152685.
- ^ Santos N, Hoshino Y. Global distribution of rotavirus serotypes/genotypes and its implication for the development and implementation of an effective rotavirus vaccine. Rev. Med. Virol. 2005, 15 (1): 29–56. PMID 15484186. doi:10.1002/rmv.448.
- ^ Desselberger U, Iturriza-Gómara M, Gray JJ. Rotavirus epidemiology and surveillance. Novartis Found. Symp. 2001, 238: 125–47; discussion 147–52. PMID 11444024. doi:10.1002/0470846534.ch9.
- ^ Desselberger U, Wolleswinkel-van den Bosch J, Mrukowicz J, Rodrigo C, Giaquinto C, Vesikari T. Rotavirus types in Europe and their significance for vaccination. Pediatr. Infect. Dis. J. 2006, 25 (1 Suppl.): S30–41 [2008-12-22]. PMID 16397427. doi:10.1097/01.inf.0000197707.70835.f3. (原始内容存档于2013-05-11).
- ^ Chan WK, Penaranda ME, Crawford SE, Estes MK. Two glycoproteins are produced from the rotavirus neutralization gene. Virology. 1986, 151 (2): 243–52. PMID 3010552. doi:10.1016/0042-6822(86)90046-2.
- ^ 97.0 97.1 Pesavento JB, Crawford SE, Estes MK, Prasad BV. Rotavirus proteins: structure and assembly. Curr. Top. Microbiol. Immunol. 2006, 309: 189–219. PMID 16913048. doi:10.1007/3-540-30773-7_7.
- ^ Prasad BV, Chiu W. Structure of rotavirus. Curr. Top. Microbiol. Immunol. 1994, 185: 9–29. PMID 8050286.
- ^ Patton JT. Structure and function of the rotavirus RNA-binding proteins. J. Gen. Virol. 1995,. 76 (Pt 11): 2633–44. PMID 7595370. doi:10.1099/0022-1317-76-11-2633. (原始内容 (PDF)存档于2012-12-09).
- ^ Patton JT. Rotavirus RNA replication and gene expression. Novartis Found. Symp. 2001, 238: 64–77; discussion 77–81. PMID 11444036. doi:10.1002/0470846534.ch5.
- ^ Vásquez-del Carpió R, Morales JL, Barro M, Ricardo A, Spencer E. Bioinformatic prediction of polymerase elements in the rotavirus VP1 protein. Biol. Res. 2006, 39 (4): 649–59 [2008-12-22]. PMID 17657346. (原始内容存档于2017-12-01).
- ^ Arnoldi F, Campagna M, Eichwald C, Desselberger U, Burrone OR. Interaction of rotavirus polymerase VP1 with nonstructural protein NSP5 is stronger than that with NSP2. J. Virol. 2007, 81 (5): 2128–37 [2008-12-22]. PMID 17182692. doi:10.1128/JVI.01494-06. (原始内容存档于2011-09-28).
- ^ Fresco LD, Buratowski S. Active site of the mRNA-capping enzyme guanylyltransferase from Saccharomyces cerevisiae: similarity to the nucleotidyl attachment motif of DNA and RNA ligases (PDF). Proc. Natl. Acad. Sci. U.S.A. 1994, 91 (14): 6624–8. PMID 8022828. doi:10.1073/pnas.91.14.6624.
- ^ Gardet A, Breton M, Fontanges P, Trugnan G, Chwetzoff S. Rotavirus spike protein VP4 binds to and remodels actin bundles of the epithelial brush border into actin bodies. J. Virol. 2006, 80 (8): 3947–56 [2008-12-22]. PMID 16571811. doi:10.1128/JVI.80.8.3947-3956.2006. (原始内容存档于2011-09-28).
- ^ Arias CF, Isa P, Guerrero CA, Méndez E, Zárate S, López T, Espinosa R, Romero P, López S. Molecular biology of rotavirus cell entry. Arch. Med. Res. 2002, 33 (4): 356–61. PMID 12234525. doi:10.1016/S0188-4409(02)00374-0.
- ^ Konno T, Suzuki H, Kitaoka S, Sato T, Fukuhara N, Yoshie O, Fukudome K, Numazaki Y. Proteolytic enhancement of human rotavirus infectivity. Clin. Infect. Dis. 1993,. 16 Suppl 2: S92–7. PMID 8384014.
- ^ Hoshino Y, Jones RW, Kapikian AZ. Characterization of neutralization specificities of outer capsid spike protein VP4 of selected murine, lapine, and human rotavirus strains. Virology. 2002, 299 (1): 64–71. PMID 12167342. doi:10.1006/viro.2002.1474.
- ^ Hua J, Mansell EA, Patton JT. Comparative analysis of the rotavirus NS53 gene: conservation of basic and cysteine-rich regions in the protein and possible stem-loop structures in the RNA. Virology. 1993, 196 (1): 372–8. PMID 8395125. doi:10.1006/viro.1993.1492.
- ^ Kattoura MD, Chen X, Patton JT. The rotavirus RNA-binding protein NS35 (NSP2) forms 10S multimers and interacts with the viral RNA polymerase. Virology. 1994, 202 (2): 803–13. PMID 8030243. doi:10.1006/viro.1994.1402.
- ^ Taraporewala ZF, Patton JT. Nonstructural proteins involved in genome packaging and replication of rotaviruses and other members of the Reoviridae. Virus Res. 2004, 101 (1): 57–66. PMID 15010217. doi:10.1016/j.virusres.2003.12.006.
- ^ Poncet D, Aponte C, Cohen J. Rotavirus protein NSP3 (NS34) is bound to the 3' end consensus sequence of viral mRNAs in infected cells. J. Virol. 1993, 67 (6): 3159–65 [2008-12-23]. PMID 8388495. (原始内容 (PDF)存档于2011-09-28).
- ^ Dong Y, Zeng CQ, Ball JM, Estes MK, Morris AP. The rotavirus enterotoxin NSP4 mobilizes intracellular calcium in human intestinal cells by stimulating phospholipase C-mediated inositol 1,4,5-trisphosphate production. Proc. Natl. Acad. Sci. U.S.A. 1997, 94 (8): 3960–5 [2008-12-23]. PMID 9108087. doi:10.1073/pnas.94.8.3960. (原始内容存档于2021-02-12).
- ^ Afrikanova I, Miozzo MC, Giambiagi S, Burrone O. Phosphorylation generates different forms of rotavirus NSP5. J. Gen. Virol. 1996,. 77 ( Pt 9): 2059–65. PMID 8811003. doi:10.1099/0022-1317-77-9-2059. (原始内容存档于2012-05-26).
- ^ Rainsford EW, McCrae MA. Characterization of the NSP6 protein product of rotavirus gene 11. Virus Res. 2007, 130 (1–2): 193–201. PMID 17658646. doi:10.1016/j.virusres.2007.06.011.
- ^ Mohan KV, Atreya CD. Nucleotide sequence analysis of rotavirus gene 11 from two tissue culture-adapted ATCC strains, RRV and Wa. Virus Genes. 2001, 23 (3): 321–9. PMID 11778700. doi:10.1023/A:1012577407824.
- ^ Desselberger U. Rotavirus: basic facts. In Rotaviruses Methods and Protocols. Ed. Gray, J. and Desselberger U. Humana Press, 2000, pp. 1–8. ISBN 0-89603-736-3
- ^ Patton JT. Rotavirus RNA replication and gene expression. In Novartis Foundation. Gastroenteritis Viruses, Humana Press, 2001, pp. 64–81. ISBN 0-471-49663-4
- ^ Jayaram H, Estes MK, Prasad BV. Emerging themes in rotavirus cell entry, genome organization, transcription and replication. Virus Res. 2004, 101 (1): 67–81. PMID 15010218. doi:10.1016/j.virusres.2003.12.007.
- ^ Patton JT, Vasquez-Del Carpio R, Spencer E. Replication and transcription of the rotavirus genome. Curr. Pharm. Des. 2004, 10 (30): 3769–77. PMID 15579070. doi:10.2174/1381612043382620.
- ^ Light JS, Hodes HL. Studies on epidemic diarrhea of the new-born: Isolation of a Filtrable Agent Causing Diarrhea in Calves. Am. J. Public Health Nations Health. 1943, 33 (12): 1451–1454 [2008-12-20]. PMID 18015921. (原始内容存档于2019-12-16).
- ^ Mebus CA, Wyatt RG, Sharpee RL; et al. Diarrhea in gnotobiotic calves caused by the reovirus-like agent of human infantile gastroenteritis. Infect. Immun. 1976, 14 (2): 471–4 [2008-12-20]. PMID 184047. (原始内容 (PDF)存档于2011-09-29).
- ^ Rubenstein D, Milne RG, Buckland R, Tyrrell DA. The growth of the virus of epidemic diarrhoea of infant mice (EDIM) in organ cultures of intestinal epithelium. British journal of experimental pathology. 1971, 52 (4): 442–45. PMID 4998842.
- ^ 123.0 123.1 Woode GN, Bridger JC, Jones JM, Flewett TH, Davies HA, Davis HA, White GB. Morphological and antigenic relationships between viruses (rotaviruses) from acute gastroenteritis in children, calves, piglets, mice, and foals. Infect. Immun. 1976, 14 (3): 804–10 [2008-12-20]. PMID 965097. (原始内容 (PDF)存档于2011-09-29).
- ^ Bishop RF, Davidson GP, Holmes IH, Ruck BJ. Letter: Evidence for viral gastroenteritis. N. Engl. J. Med. 1973, 289 (20): 1096–7. PMID 4742237.
- ^ 125.0 125.1 Flewett TH, Woode GN. The rotaviruses. Arch. Virol. 1978, 57 (1): 1–23. PMID 77663. doi:10.1007/BF01315633.
- ^ Flewett TH, Bryden AS, Davies H, Woode GN, Bridger JC, Derrick JM. Relation between viruses from acute gastroenteritis of children and newborn calves. Lancet. 1974, 2 (7872): 61–3. PMID 4137164. doi:10.1016/S0140-6736(74)91631-6.
- ^ Matthews RE. Third report of the International Committee on Taxonomy of Viruses. Classification and nomenclature of viruses. Intervirology. 1979, 12 (3-5): 129–296. PMID 43850.
- ^ Beards GM, Pilfold JN, Thouless ME, Flewett TH. Rotavirus serotypes by serum neutralisation. J. Med. Virol. 1980, 5 (3): 231–7. PMID 6262451. doi:10.1002/jmv.1890050307.
- ^ Urasawa T, Urasawa S, Taniguchi K. Sequential passages of human rotavirus in MA-104 cells. Microbiol. Immunol. 1981, 25 (10): 1025–35. PMID 6273696.
- ^ Vesikari T, Isolauri E, Delem A; et al. Clinical efficacy of the RIT 4237 live attenuated bovine rotavirus vaccine in infants vaccinated before a rotavirus epidemic. J. Pediatr. 1985, 107 (2): 189–94. PMID 3894608. doi:10.1016/S0022-3476(85)80123-2.
- ^ 即惠氏大药厂(Wyeth)所制造的“轮盾”(Rotashield®)
- ^ Rotavirus vaccine for the prevention of rotavirus gastroenteritis among children. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 1999, 48 (RR-2): 1–20. PMID 10219046.
- ^ Kapikian AZ. A rotavirus vaccine for prevention of severe diarrhoea of infants and young children: development, utilization and withdrawal. Novartis Found. Symp. 2001, 238: 153–71; discussion 171–9. PMID 11444025. doi:10.1002/0470846534.ch10.
- ^ Bines JE. Rotavirus vaccines and intussusception risk. Curr. Opin. Gastroenterol. 2005, 21 (1): 20–5 [2008-12-20]. PMID 15687880. (原始内容存档于2013-05-11).
- ^ Bines J. Intussusception and rotavirus vaccines. Vaccine. 2006, 24 (18): 3772–6. PMID 16099078. doi:10.1016/j.vaccine.2005.07.031.
- ^ Dennehy PH. Rotavirus vaccines: an overview. Clin. Microbiol. Rev. 2008, 21 (1): 198–208 [2008-12-20]. PMID 18202442. doi:10.1128/CMR.00029-07. (原始内容存档于2011-09-28).
